
【題目】鐵有兩種氯化物,都是重要的化工試劑,一些性質及制備方法如下:
氯化鐵:熔點306℃,沸點315℃,易吸收空氣中的水分而潮解。工業上采用向500600℃的鐵粉中通入氯氣來生產無水氯化鐵。
氯化亞鐵:熔點670℃, 易升華。工業上采用向熾熱鐵粉中通入氯化氫來生產無水氯化亞鐵。實驗室可用下圖所示的裝置模擬工業生產無水氯化鐵,請回答相關問題。

(1)裝置A用于KMnO4固體與濃鹽酸反應制氯氣,反應的離子方程式為______________。
(2)彎曲的a管所起的作用是_____________________;裝置采用較粗的導管來連接裝鐵粉的硬質玻璃管和廣口瓶C,其目的是_____________________________________。
(3)導管b 口應與_______________ (從虛線框裝置中選擇裝置的字母序號)連接,這樣可避免反應系統與環境間的相互影響。
(4)實驗完成后,取廣口瓶C中收集到的產物進行如下測定
①稱取4.52g樣品溶于過量的稀鹽酸中:②加入足量H2O2;③再加入足量NaOH溶液:④過濾、洗滌后灼燒沉淀;⑤稱量所得紅棕色固體為2.40g。則該樣品中Fe元素的質量分數為______%。
(5)由上分析數據和計算得出結論:
①用此裝置制得的無水氯化鐵含鐵_________偏高,偏低),顯然其中含有較多________的雜質。
②若要得到較純凈的無水氯化鐵,可采取的裝置改進措施是___________________。
【答案】2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O平衡氣壓,便于液體能順利流下防止產物降溫固化造成導管堵塞F37.17%偏高FeCl2在裝置A、 B間加裝一個盛有飽和食鹽水的洗氣瓶
【解析】
(1)高錳酸鉀和濃鹽酸反應生成氯化錳和氯化鉀和氯氣和水,離子方程式為: 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;(2)彎曲的a管可以平衡分液漏斗和圓底燒瓶中的氣壓,便于液體能順利流下;裝置采用較粗的導管來連接莊鐵粉的硬質玻璃管和廣口瓶,是為了防止產物降溫固化造成導管堵塞。 (3)因為空氣中的水蒸氣對氯化鐵有影響,所以用盛有堿石灰的干燥管連接,所以連接F管口。 (4)紅棕色固體為氧化鐵,其物質的量為2.40/160=0.015mol,則樣品中鐵的物質的量為0.03mol,質量為0.03×51.68克,鐵元素的質量分數為1.68/4.52=37.17% 。(5) ①在氯化鐵中鐵的質量分數為56/162.5=34.46%,所以說明用此裝置制得的氯化鐵含鐵偏高。顯然其中含有較多的FeCl2 ;②要想得到純凈的氯化鐵,可以在裝置A、 B間加裝一個盛有飽和食鹽水的洗氣瓶,除去氯氣中含有的氯化氫氣體。


科目:高中化學 來源: 題型:
【題目】下列說法中,正確的是:
A. H2O和D2O互為同位素
B. 金剛石和石墨互為同分異構體
C. 所有烷烴互為同系物
D. 乙醇(CH3CH2OH)和二甲醚(CH3-O-CH3)互為同分異構體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關從海帶中提取碘的實驗原理和裝置能達到實驗目的的是

A. 用裝置甲灼燒碎海帶
B. 用裝置乙過濾海帶灰的浸泡液
C. 用裝置丙制備用于氧化浸泡液中I的Cl2
D. 用裝置丁吸收氧化浸泡液中I后的Cl2尾氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫化氫裂解制取氫氣的反應為2H2S(g)![]() 2H2(g)+S2(g)。向恒容密閉容器中充入一定量的H2S氣體,測得體系中氣體的平衡組成與溫度的關系如圖所示。下列說法正確的是
2H2(g)+S2(g)。向恒容密閉容器中充入一定量的H2S氣體,測得體系中氣體的平衡組成與溫度的關系如圖所示。下列說法正確的是

A. 該反應平衡常數隨溫度升高而增大
B. M點時容器內氣體總壓強比N的大
C. M點時,H2S的平衡轉化率為50%
D. 維持M點溫度不變,向容器中再充入0.2molH2S、0.2molH2、0.1molS2(g),則v(正) = v(逆)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏伽德羅常數的值,下列敘述正確的是( )
A. 1L1.0mo1L-1的NaAlO2水溶液中含有的氧原子數為2NA
B. 標準狀況下,11.2LNO與11.2LO2混合后所含分子數為0.75NA
C. Na2O和Na2O2混合物的物質的量為1mol,其中含有的陰離子總數為NA
D. 室溫下,將9g鋁片投入0.5L 18.4molL-1的H2SO4中,轉移的電子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】明礬[KAl(SO4)2·12H2O]是一復鹽,在造紙等方面應用廣泛。某興趣小組采用10.0g廢易拉罐(含90%的Al,還含有少量的Fe、Mg等雜質)制備明礬的實驗方案如下:
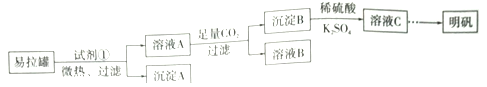
(1)試劑①應選用_____________(填代號)。
a.鹽酸 b.H2SO4溶液 c.氯化鈉溶液 d.NaOH溶液
(2)易拉罐溶解過程中主要反應的化學方程式為____________________。
(3)溶液B中溶質的主要成分為____________________ (填化學式)。
(4)從溶液C中得到明礬的實驗操作步驟為蒸發濃縮、__________(填操作名稱)、過濾、洗滌、干燥。如下圖所示,蒸發操作中的一處錯誤是_____________。

(5)該小組在實驗完成之后,得到118.5 g明礬,則明礬的回收率為_____________。(已知:明礬的摩爾質量為474g·mol-1)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表前三周期的一部分:

(1)判斷 Y ____ Z _____ R _____(寫元素符號)。
(2)寫出X的氫化物的化學式:_________,W的氫化物的化學式_________,其沸點比較: ________>________ ______________ (填化學式)
(3)下圖是X的基態原子的電子排布圖,其中有一個是錯誤的,它不能作為基態原子的電子排布 圖是因為它不符合________。


(4)以上五種元素中,________(填元素符號)元素第一電離能最大。_____元素電負性最大,Y的基態原子的電子排布式為________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com