
 kJ
kJ 。在2L恒容密閉容器中各物質(zhì)的濃度隨時間變化的曲線如圖所示。下列說法錯誤的是
。在2L恒容密閉容器中各物質(zhì)的濃度隨時間變化的曲線如圖所示。下列說法錯誤的是
| A.前25min內(nèi)反應放出的熱量為46.lkJ |
| B.第25min改變的條件是將NH3從反應體系中分離出去 |
| C.若第60min時反應又達到了平衡,則時段Ⅲ改變的條件是降低溫度 |
| D.若時段I中投入物質(zhì)的濃度為原來的2倍,則反應物的轉(zhuǎn)化率增大,平衡常數(shù)不變 |
A
解析試題分析:A、前25min反應的N2為:0.50mol/L×2L=1mol,根據(jù)熱化學方程式可知反應放出的熱量為92.2kJ,錯誤;B、第25min NH3的濃度減小,而N2和H2的濃度隨平衡的移動逐漸減小,所以改變的條件是將NH3從反應體系中分離出去,正確;C、平衡向正反應方向移動,而且N2、H2、NH3的濃度隨著平衡的移動逐漸變化,所以時段Ⅲ改變的條件是降低溫度,正確;D、若時段I中投入物質(zhì)的濃度為原來的2 倍,容器內(nèi)壓強增大,平衡更有利于向正反應方向移動,反應物的轉(zhuǎn)化率增大,但平衡常數(shù)不變,正確。
考點:本題考查熱化學方程式、化學平衡。


科目:高中化學 來源: 題型:單選題
為了說明影響化學反應快慢的因素,甲、乙、丙、丁四位學生分別設(shè)計了如下A~D四個實驗,你認為得出的結(jié)論不正確的是 ( )
| A.在相同條件下,等質(zhì)量的大理石塊和大理石粉與相同的鹽酸反應,大理石粉反應快 |
| B.將相同大小、形狀的鎂條和鋁條分別與相同濃度的鹽酸反應時,兩者速率一樣大 |
| C.將濃硝酸分別放在冷暗處和強光照射下,會發(fā)現(xiàn)光照可以加快濃硝酸的分解 |
| D.兩支試管中分別加入相同濃度相同體積的雙氧水,其中一支試管中再加入幾滴氯化鐵溶液,產(chǎn)生氧氣的快慢不同 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
碘單質(zhì)難溶于水卻易溶于KI溶液。碘水中加入KI溶液發(fā)生反應:I2(aq)+I-(aq)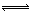 I3-(aq),該反應的平衡常數(shù)與溫度的關(guān)系如右圖,下列說法不正確的是
I3-(aq),該反應的平衡常數(shù)與溫度的關(guān)系如右圖,下列說法不正確的是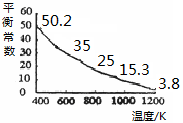
| A.上述正反應為放熱反應 |
| B.上述體系中加入苯,平衡不移動 |
| C.可運用該反應原理除去硫粉中少量的碘單質(zhì) |
| D.實驗室配制碘水時,為增大碘單質(zhì)的溶解度可加入適量KI溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
對于100mL1mol/L鹽酸與鐵片的反應,采取下列措施:①升高溫度;②改用100mL3mol/L鹽酸;③多用300mL1mol/L鹽酸;④用等量鐵粉代替鐵片;⑤改用98%的硫酸。其中能使反應速率加快的是( )
| A.①③④ | B.①②④ | C.①②③④ | D.①②③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
溫度為T時,向2.0 L恒容密閉容器中充入1.0 mol PCl5,反應PCl5(g)=PCl3(g)+Cl2(g)經(jīng)過一段時間后達到平衡。反應過程中測定的部分數(shù)據(jù)見下表:
| t / s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
化學平衡狀態(tài)I、II、Ⅲ的相關(guān)數(shù)據(jù)如下表: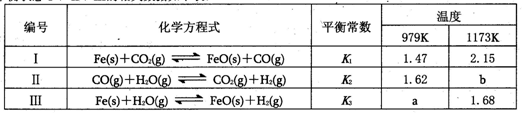
根據(jù)以上信息判斷,下列結(jié)論錯誤的是
| A.a(chǎn)>b |
| B.升高溫度平衡狀態(tài)Ⅲ向正反應方向移動 |
| C.增大壓強;平衡狀態(tài)II不移動 |
| D.反應II、Ⅲ均為放熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
T℃時在2 L的密閉容器中X(g)與Y(g)發(fā)生反應生成Z(g)。反應過程中X、Y、Z的濃度變化如圖1所示;若保持其他條件不變,反應溫度分別為T1和T2時,Y的體積分數(shù)與時間的關(guān)系如圖2所示。則下列結(jié)論正確的是
| A.反應進行的前3 min內(nèi),用X表示的反應速率v(X)=0.3 mol·(L·min)-1 |
B.容器中發(fā)生的反應可表示為3X(g)+Y(g)  2Z(g) 2Z(g) |
| C.保持其他條件不變,升高溫度,反應的化學平衡常數(shù)K減小 |
| D.若改變反應條件,使反應進程如圖3所示,則改變的條件是增大壓強 |
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com