
【題目】反應4A(g)+3B(g)=2C(g)+D(g),經2min,B的濃度減少0.6mol·L-1。對此反應速率的表示,正確的是
①用A表示的反應速率是0.4 mol·L-1·min-1 ②分別用B、C、D表示的反應速率其比值為3∶ 2∶1 ③在2 min末的反應速率,用B表示是0.3mol·L-1·min-1④在這2 min內用B表示的反應速率的值是逐漸減小的,用C表示的反應速率的值是逐漸增大的( )
A. ①② B. ③ C. ① D. ②④
【答案】A
【解析】①2min內B的濃度減少0.6mol·L-1,用B表示的平均速率為:v(B)=0.6mol·L-1÷2min=0.3mol·L-1·min-1,同一反應用不同物質表示的速率之比等于化學計量數之比,所以用A表示的反應速率是v(A)=![]() ×0.3mol·L-1·min-1=0.4 mol·L-1·min-1,故①正確;②同一反應用不同物質表示的速率之比等于化學計量數之比,所以用B、C、D表示的反應速率其比值為3:2:1,故②正確;③由上面分析知,2min內用B表示的平均速率為0.3mol·L-1·min-1,在2 min末的反應速率應為瞬時速率,用B表示不是0.3mol·L-1·min-1,故③錯誤;④隨反應進行反應物的濃度降低,反應速率減慢,所以2min內用B和C表示的反應速率都是逐漸減小的,故④錯誤。綜上①②正確,選A。
×0.3mol·L-1·min-1=0.4 mol·L-1·min-1,故①正確;②同一反應用不同物質表示的速率之比等于化學計量數之比,所以用B、C、D表示的反應速率其比值為3:2:1,故②正確;③由上面分析知,2min內用B表示的平均速率為0.3mol·L-1·min-1,在2 min末的反應速率應為瞬時速率,用B表示不是0.3mol·L-1·min-1,故③錯誤;④隨反應進行反應物的濃度降低,反應速率減慢,所以2min內用B和C表示的反應速率都是逐漸減小的,故④錯誤。綜上①②正確,選A。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】實驗室以軟錳礦(主要成分為MnO2,還有少量FeO、Fe2O3、MgO和Al2O3雜質)為原料制備高錳酸鉀的流程如下圖:

(1) “酸浸”需要加熱的目的是__________,此過程中發生反應的離子方程式是______________。(任寫一條)
(2) “熔融”過程中,MnO2被KC1O3氧化成K2MnO4。
①該反應的化學方程式為_____________________。
②加入KC1O3應過量的原因除了提高MnO2利用率,還有_________________.
③將適量KClO3和KOH混合均勻后在坩堝內高溫反應,應選用坩堝為__________。(選填序號)
a.石英坩堝 b.鐵坩堝 c.氧化鋁坩堝
(3)己知:①MnO42-只存在于強堿環境(pH>13.5)中,當pH降低時,MnO42-會歧化為MnO4-和MnO2;②飽和碳酸鉀溶液的pH約為12.3,飽和碳酸氫鉀溶液的pH約為8.8;③相關物質的溶解度曲線如下圖。

請補充完整由浸取液制備KMnO4晶體的實驗方案:向浸取液中緩緩通入CO2,_____________,低溫供干得KMnO4晶體。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鈰(58Ce)常用于制作稀土磁性材料,可應用于制造玻璃、打火石、陶瓷和合金等.已知:Ce4++Fe2+═Ce3++Fe3+ . 下列說法正確的是( )
A.Ce元素位于元素周期表第六周期第IIIB族
B.![]() Ce、
Ce、 ![]() Ce是同素異形體
Ce是同素異形體
C.鈰能溶于HI溶液,發生反應的離子方程式為:Ce+4H+=Ce4++2H2
D.鈰的原子核外有58個電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉬(Mo)是一種過渡金屬元素,通常用作合金及不銹鋼的添加劑。鉬酸鈉晶體(Na2MoO4·2H2O)是一種無公害型冷卻水系統的金屬緩蝕劑。工業上利用鉬精礦(主要成分是不溶于水的MoS2)制備鉬酸鈉及制備金屬鉬的主要流程圖如圖所示:

(1) Na2MoO4·2H2O中鉬元素的化合價是_________。結晶得到的鉬酸鈉晶體是粗產品,要得到純凈的鉬酸鈉晶體,下一步需要進行的操作是_________________(填名稱)。
(2)灼燒過程中鉬精礦發生的主要反應的化學方程式為MoS2+O2→MoO3+SO2(未配平),該反應中氧化產物是__________(填化學式);若反應中生成36.0 gMoO3,反應中,轉移電子的數目為____________。
(3)尾氣中含有SO2需要處理,下列不能用作吸收劑的是_______________(填序號)。
a.Ca(OH)2 b. HNO3 c. Na2CO3
(4)加入Na2CO3溶液時發生反應的化學方程式為_____________________。
(5)利用鋁熱反應也可回收金屬鉬,寫出MoO3發生鋁熱反應的化學方程式_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中存在XO-,且X為短周期元素,則一定能在該溶液中大量共存的離子組是( )。
A. Na+、H+、SO42-、I-B. Na+、Ca2+、CO32-、Al3+
C. Na+、K+、Fe2+、H+D. K+、SO42-、Cl-、CO32-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向一容積不變的密閉容器中充入一定量A和B,發生如下反應:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定條件下,容器中A、C的物質的量濃度隨時間變化的曲線如圖所示。請回答下列問題:
yC(g) ΔH<0,一定條件下,容器中A、C的物質的量濃度隨時間變化的曲線如圖所示。請回答下列問題:
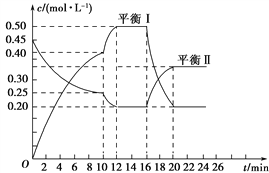
(1)用A的濃度變化表示該反應在0~10 min內的平均反應速率v(A)=______________________。
(2)根據圖示可確定x∶y=________。
(3)0~10 min容器內壓強________(填“變大”、“不變”或“變小”)。
(4)推測第10 min引起曲線變化的反應條件可能是______________________;第16min引起曲線變化的反應條件可能是________________________。
①減壓 ②增大A的濃度 ③增大C的量 ④升溫⑤降溫 ⑥加催化劑
(5)若平衡Ⅰ的平衡常數為K1,平衡Ⅱ平衡常數為K2,則K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,向2L體積固定的密閉容器中加入1molHI,2HIH2(g)+I2(g)△H>0,H2的物質的量隨時間的變化如圖示,下列說法正確的是( )
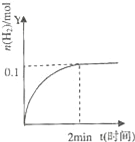
A. 該溫度下,反應的平衡常數是![]()
B. 0~2min內的HI的平均反應速率為0.05molL﹣1min﹣1
C. 恒壓下向該體系中加入N2,平衡不移動,反應速率不變
D. 升高溫度,平衡向正反應方向移動,只有正反應速率加快
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com