
【題目】有一包鐵粉和氧化銅混合均勻的粉末樣品4.40g,加入50mL稀硫酸恰好充分反應后,得到只含一種金屬陽離子的淺綠色溶液和1.28g固體銅.并放出H2 . 試計算:
(1)固體銅的物質的量為mol,該樣品中鐵粉和氧化銅的物質的量之比為 .
(2)硫酸的物質的量的濃度molL﹣1 , 產生H2在標準狀況下的體積L.
【答案】
(1)0.02;5:2
(2)1.0;0.672
【解析】解:(1)鐵粉和氧化銅混合均勻的粉末樣品4.40g,加入50mL稀硫酸恰好充分反應后,得到只含一種金屬陽離子的淺綠色溶液和1.28g固體銅,說明反應后溶質為硫酸亞鐵,CuO中的銅元素完全反應轉化成Cu單質,1.28g銅的物質的量為: ![]() =0.02mol,根據銅元素質量守恒可知原混合物中CuO的物質的量為0.02mol,質量為:80g/mol×0.02mol=1.6g,則原混合物中鐵粉的質量為:4.4g﹣1.6g=2.8g,鐵粉的物質的量為:
=0.02mol,根據銅元素質量守恒可知原混合物中CuO的物質的量為0.02mol,質量為:80g/mol×0.02mol=1.6g,則原混合物中鐵粉的質量為:4.4g﹣1.6g=2.8g,鐵粉的物質的量為: ![]() =0.05mol,所以該樣品中鐵粉和氧化銅的物質的量之比=0.05mol:0.02mol=5:2,
=0.05mol,所以該樣品中鐵粉和氧化銅的物質的量之比=0.05mol:0.02mol=5:2,
所以答案是:0.02;5:2;(2)反應后溶質為硫酸亞鐵,硫酸恰好反應,根據硫酸根離子守恒可知50mL稀硫酸中含有硫酸的物質的量為:n(H2SO4)=n(FeSO4)=n(Fe)=0.05mol,該稀硫酸的濃度為:c(H2SO4)= ![]() =1.0mol/L;根據(1)可知原混合物中含有0.05molFe、0.02molCuO,根據根據電子守恒可知:2n(Fe)=2n(H2)+2n(CuO),則n(H2)=0.05mol﹣0.02mol=0.03mol,標準狀況下0.03mol氫氣的體積為:22.4L/mol×0.03mol=0.672L,
=1.0mol/L;根據(1)可知原混合物中含有0.05molFe、0.02molCuO,根據根據電子守恒可知:2n(Fe)=2n(H2)+2n(CuO),則n(H2)=0.05mol﹣0.02mol=0.03mol,標準狀況下0.03mol氫氣的體積為:22.4L/mol×0.03mol=0.672L,
所以答案是:1.0;0.672.


科目:高中化學 來源: 題型:
【題目】某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Fe2+和Na+ . 某同學為了確認其成分,取部分溶液,設計并完成了如圖實驗:下列說法正確的是( ) 
A.原溶液中c(Fe3+)=0.2molL﹣1
B.SO42﹣、NH4+、Na+一定存在,CO32﹣一定不存在
C.要確定原溶液中是否含有Fe2+ , 其操作為取少量原溶液于試管中,加KSCN溶液,再加入適量氯水,溶液呈血紅色,則含有Fe2+
D.溶液中至少有4種離子存在,其中Cl﹣一定存在,且c(Cl﹣)≥0.2molL﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列物質:①NaCO310H2O晶體 ②銅 ③硫酸溶液 ④CO2 ⑤NaHSO4固體 ⑥Ba(OH)2固體 ⑦紅褐色的氫氧化鐵膠體 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3固體。
(1)上述物質屬于電解質的有(填編號)。
(2)上述物質中有兩種物質之間可發生離子反應:H++OH-=H2O,寫出該離子反應對應的化學方程式。
(3)制取⑦的化學方程式;將⑥的溶液滴加到⑤的溶液中至恰好完全沉淀時的離子方程式。
(4)17.1g⑩溶于水配成250mL溶液,SO42-的物質的量濃度為。
(5)②與⑨發生反應的化學方程式為:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O當有0.6mol電子轉移時,生成的氣體標準狀況下的體積為L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,將20.0 g質量分數為14.0%的KNO3溶液與30.0 g質量分數為24.0%的KNO3溶液混合,得到的密度為1.15 g/cm3的混合溶液。計算(寫出計算步驟):
(1)混合后溶液的質量分數。
(2)混合后溶液的物質的量濃度(計算結果保留兩位小數,下同)。
(3)在1 000 g水中需溶解多少摩爾KNO3才能使其濃度恰好與上述混合后溶液的濃度相等?
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為實驗室制取純凈、干燥的Cl2 , 并進行檢驗Cl2性質實驗的裝置。其中E瓶中放有干燥紅色布條;F中為銅網,F右端出氣管口附近放有脫脂棉。
試回答:
(1)A中所放試劑為 , B中所放試劑為 , 二者反應的化學方程式為 , 該反應中的氧化劑是;
(2)C中試劑是;D中試劑的作用是;
(3)E中現象是; F中現象是 , 其反應的化學方程式為;F管中脫脂棉的作用是
(4)H中試劑為;
(5)整套裝置中有兩處用酒精燈加熱,兩處酒精燈點燃的先后順序是(用①或②填寫)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】加熱條件下,將24.0gCuO和Fe2O3的混合物與足量的CO完全反應,并將反應后的氣體全部通入到足量的澄清石灰水中,得到白色沉淀40.0g.下列有關敘述中不正確的是( )
A.原混合物中CuO和Fe2O3的物質的量的比為1:1
B.參加反應的CO的質量為11.2g
C.原混合物中Fe元素的質量為5.6g
D.原混合物中CuO的質量分數約為33.3%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹽酸在不同的反應中,可以分別表現出酸性、氧化性和還原性。現在有如下三個反應,有關判斷正確的是( )
①Zn+2HCl ![]() ZnCl2+H2↑;②NaOH+HCl
ZnCl2+H2↑;②NaOH+HCl ![]() NaCl+H2O;
NaCl+H2O;
③2HCl ![]() H2↑+Cl2↑
H2↑+Cl2↑
選項 | 有關判斷 |
A | 反應①是置換反應,HCl表現還原性 |
B | 反應②是復分解反應,HCl表現氧化性 |
C | 反應③中HCl既表現氧化性也表現還原性 |
D | 反應①中氫原子失去電子 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請根據所學知識回答下列問題:
(1)已知常溫時紅磷比白磷穩定,比較下列反應中△H的大小:△H1△H2 .
①P4(白磷,s)+5O2(g)═2P2O5(s)△H1
②4P(紅磷,s)+5O2(g)═2P2O5(s)△H2
(2)已知:稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJmol﹣1 , 則濃硫酸與稀氫氧化鈉溶液反應生成1mol水,放出的熱量57.3kJ.
(3)已知:C3H8(g )═CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJmol﹣1
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=32.4kJmol﹣1
則相同條件下,反應C3H8(g)═CH3CH=CH2 (g)+H2(g)的△H=kJmol﹣1
(4)如圖是一種鈉硫高能電池的結構示意圖,M由Na2O和Al2O3制得,其作用是導電和隔膜,該電池反應為2Na+xS=Na2Sx . 該電池正極的電極反應式為 .
用該電池作電源進行鐵件鍍銅時,若電鍍池中兩電極的質量開始相同,電鍍完成后取出洗凈、烘干、稱量,二者質量差為25.6g,則理論上該電池負極消耗的質量為g.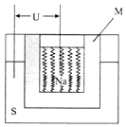
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com