
【題目】
K、Fe、Ni均為重要的合金材料,在工業生產、科技、國防領域有著廣泛的用途,請回答下列問題:
(1)K元素處于元素周期表的_____ 區,其基態原子中,核外電子占據的電子云輪廓圖為球形的能級有______個。
(2)KCl 和NaCl 均為重要的化學試劑,KCl 的熔點低于NaCl的原因為___________。
(3)從原子結構角度分析,Fe3+比Fe2+更穩定的原因是__________。
(4)NiSO4 溶于氨水形成[Ni (NH3)6]SO4。
①寫出一種與[Ni(NH3)6]SO4中的陰離子互為等電子體的分子的分子式_________。
②1mol[Ni(NH3)6]SO4中含有σ鍵的數目為___________。
③NH3 的VSEPR模型為_____ ;中心原子的雜化形式為_____,其雜化軌道的作用為__________。
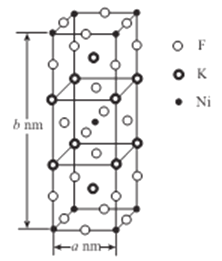
(5)K、Ni、F三種元素組成的一種晶體的長方體晶胞結構如圖所示。若NA為阿伏加德羅常數的值,該晶體的密度ρ=______g/cm3(用代數式表示)。
【答案】 s 4 K+半徑大于Na+半徑,KCl晶體的晶格能小于NaCl晶體的晶格能 基態Fe3+的價電子排布式為3d5,為半充滿狀態,更穩定 CX4、SiX4(X表示鹵素原子)中任寫一種 28NA 四面體形 sp3 形成σ鍵和容納孤電子對 ![]()
【解析】(1). 基態K原子的價層電子排布式為4s1,所以K元素處于元素周期表的s區,s能級的電子云輪廓圖為球形,則有1s、2s、3s、4s共4個,故答案為:s;4;
(2). KCl和NaCl均為離子晶體,離子晶體的熔點高低由晶格能決定,因K+半徑大于Na+半徑, KCl晶體的晶格能小于NaCl晶體的晶格能,所以KCl的熔點低于NaCl的熔點,故答案為:K+半徑大于Na+半徑,KCl晶體的晶格能小于NaCl晶體的晶格能;
(3). 基態Fe3+的價電子排布式為3d5,為半充滿的穩定狀態,而基態Fe2+的價電子排布式為3d6,更容易失去1個電子,故答案為:基態Fe3+的價電子排布式為3d5,為半充滿狀態,更穩定;
(4). ①. 根據等電子體的定義,與SO42-互為等電子體的分子有:CX4、SiX4(X表示鹵素原子)等,故答案為:CX4、SiX4(X表示鹵素原子)等(任寫一種);
②. [Ni(NH3)6]SO4中Ni2+與6個NH3形成的6個配位鍵屬于σ鍵,NH3中含有3個σ鍵,SO42-中含有4個σ鍵,所以1mol[Ni(NH3)6]SO4中含有σ鍵的數目為28NA,故答案為:28NA;
③. NH3中N原子價層電子對數為4,VSEPR模型為四面體形,中心原子的雜化方式為sp3,雜化軌道的作用是形成σ鍵和容納孤電子對,故答案為:四面體形;sp3;形成σ鍵和容納孤電子對;
(5). 由晶胞結構圖可知,每個晶胞含有2個Ni原子、4個K原子、8個F原子,則晶胞的密度ρ=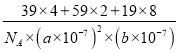 =
=![]() ,故答案為:
,故答案為: ![]() 。
。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】在恒容絕熱條件下,一定能說明反應A(g)+B(?)![]() 2C(g)已達到平衡狀態的是
2C(g)已達到平衡狀態的是
A. 容器內的密度不再變化 B. C的生成速率與A的分解速率之比為2:1
C. 混合物的平均摩爾質量不再變化 D. 容器內的溫度不再發生變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:N2(g)+3H2(g)![]() 2NH3(g) H=-92.2 kJ·mol-1 ,據此回答以下問題:
2NH3(g) H=-92.2 kJ·mol-1 ,據此回答以下問題:
(1)①某溫度下,若把 10 mol N2 與 30 mol H2置于體積為 10 L 的密閉容器內,反應達到平衡狀態時,測得混合氣體中氨的體積分數為 20%,則該溫度下反應的K=_______ (可用分數表示)。
②對于合成氨反應而言,下列有關圖像一定正確的是______(選填序號)。
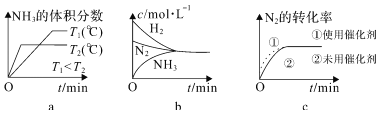
③在堿性溶液中通過電解法可以實現由 N2 制取 NH3:2N2+6H2O![]() 4NH3+3O2,陰極的電極反應式是_______________。
4NH3+3O2,陰極的電極反應式是_______________。
(2)室溫下,若將 0.1 mol·L-1 鹽酸滴入 20 mL 0.1 mol·L-1 氨水中,溶液 pH 隨加入鹽酸體積的變化曲線如下圖所示。
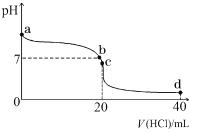
①NH3·H2O 的電離方程式是_______________。
②b 點所示溶液中的溶質是_______________。
③c 點所示溶液中,離子濃度從大到小的關系為_______________。
④常溫下,若將 amol/LNH3·H2O 與等體積的 bmol/L 的鹽酸混合,充分反應后溶液呈中性(不考慮氨水和鹽酸的揮發),則該溫度下 NH3·H2O 的電離常數Ka=___________(用含 a 和 b 的代數式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“一碳化學”是指以含一個碳原子的化合物(如:CO2、CO、CH4、CH3OH等)為初始反應物,合成一系列重要的化工原料和燃料的化學。
(1)以CO2和NH3為原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反應可表示如下:
反應I:2NH3(g)+CO2(g)=NH2COONH4(s)△H1
反應II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
總反應:2NH3(g)+CO2(g)==CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol
請回答下列問題:
①反應I的△H1=______ kJ/mol
②反應II一般在_________(填“高溫”或“低溫”)情況下有利于該反應的進行。
③一定溫度下,在體積為固定的密閉容器中按計量比進行反應I,下列能說明反應達到了平衡狀態的是__________(填序號)。
A.混合氣體的平均相對分子質量不再變化 B.容器內氣體總壓強不再變化
C.2V正(NH3)=V逆(CO2) D.容器內混合氣體的密度不再變化
④環境為真空時,在一敞開容器(非密閉容器)中加入NH2COONH4固體,足夠長時間后,反應是否建立平衡狀態? ___________(填“是”或“否”)
(2)將CO2和H2充入一定體積的密閉容器中,在兩種溫度下發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。測得CH3OH的物質的量隨時間的變化如下圖。
CH3OH(g)+H2O(g)。測得CH3OH的物質的量隨時間的變化如下圖。

①曲線I.II對應的平衡常數大小關系為KI_______KII(填“ >”、“<”或“=”)。
②一定溫度下,在容積相同且固定的兩個密閉容器中,按如下方式加入反應物,一段時間后達到平衡。
容器 | 甲 | 乙 |
反應物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmol CH3OH(g)、cmolH2O(g)(a、b、c均不為零) |
若甲容器平衡后氣體的壓強為開始的0.8倍,則甲容器平衡混合氣體中CH3OH(g)的體積分數為_______,要使平衡后乙容器與甲容器中相同組分的體積分數相等,且起始時維持化學反應向逆反應方向進行,乙容器中c的取值范圍為________。
(3)以TiO2/Cu2Al2O4為催化劑,可以將CO2和CH4直接轉化成乙酸。在不同溫度下催化劑的催化效率與乙酸的生成速率的關系如下圖,乙酸的生成速率主要取決于溫度影響的范圍是________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用酸性氫氧燃料電池為電源進行電解的實驗裝置示意圖如下圖所示。下列說法中,正確的是( )
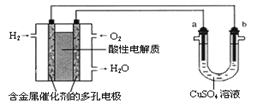
A. 燃料電池工作時,正極反應為:O2 + 2H2O + 4e-= 4OH-
B. a極是鐵,b極是銅時,b極逐漸溶解,a極上有銅析出
C. a極是粗銅,b極是純銅時,a極逐漸溶解,b極上有銅析出
D. a、b兩極均是石墨時,在相同條件下a極產生的氣體與電池中消耗的H2體積相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2SO2(g)+O2(g)![]() 2SO3(g)反應過程中的能量變化如圖所示(圖中E1表示無催化劑時正反應的活化能,E2表示無催化劑時逆反應的活化能)。下列有關敘述不正確的是
2SO3(g)反應過程中的能量變化如圖所示(圖中E1表示無催化劑時正反應的活化能,E2表示無催化劑時逆反應的活化能)。下列有關敘述不正確的是

A. 該反應的逆反應為吸熱反應,升高溫度可提高活化分子的百分數
B. 500℃、101kPa下,將1molSO2(g)和0.5molO2(g)置于密閉容器中充分反應生成SO3(g)放熱akJ,其熱化學方程式為2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 該反應中,反應物的總鍵能小于生成物的總鍵能
D. ΔH=E1-E2,使用催化劑改變活化能,但不改變反應熱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】斷腸草(Gelsemium)為中國古代九大毒藥之一,據記載能“見血封喉”,現代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分離出來的四種毒素的結構式,下列推斷正確的是
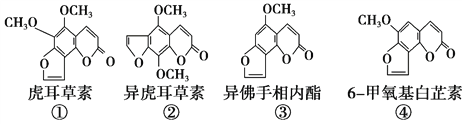
A. ①、②、③、④互為同分異構體
B. ①、③互為同系物
C. 等物質的量的②、④分別在足量氧氣中完全燃燒,前者消耗氧氣比后者少
D. ①、②、③、④均能與氫氧化鈉溶液反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機化合物A的結構簡式如下:
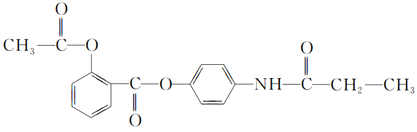
(1)A的分子式是________。
(2)A在NaOH水溶液中充分加熱后,再加入過量的鹽酸酸化后,可得到B、C、D和![]() 四種有機物,且相對分子質量大小關系為B>C>D,則B、C、D的結構簡式分別是B________;C________;D________。
四種有機物,且相對分子質量大小關系為B>C>D,則B、C、D的結構簡式分別是B________;C________;D________。
(3)下列物質中,不能與B發生化學反應的是________(填空序號)。
①濃H2SO4和濃HNO3的混合液 ②CH3CH2OH(酸催化) ③CH3CH2CH2CH3 ④Na ⑤濃溴水
(4)在B的同分異構體中,屬于1,3,5三取代苯的化合物的結構簡式為_________________。
(5)寫出B與碳酸氫鈉反應的化學方程式:___________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com