
)含硫化合物在工業生產中有廣泛的用途。
(1)SO2可用于工業生產SO3。
①在一定條件下,每生成8g SO3氣體,放熱9.83kJ。該反應的熱化學方程式為__________________
②在500℃,催化劑存在的條件下,向容積為1L的甲、乙兩個密閉容器中均充入2 mol SO2和1 mol O2。甲保持壓強不變,乙保持容積不變,充分反應后均達到平衡。
I.平衡時,兩容器中SO3體積分數的關系為:甲_______乙(填“>”、“<”或“ =”)。
II.若乙在t1 min時達到平衡,此時測得容器乙中SO2的轉化率為90%,則該反應的平衡常數為_______;保持溫度不變,t2 min時再向該容器中充入1 mol SO2和1 mol SO3,t3 min時達到新平衡。請在下圖中畫出t2~t4min內正逆反應速率的變化曲線(曲線上必須標明V正、 V逆)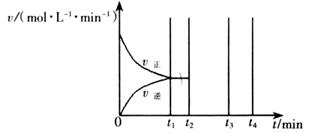
(2)硫酸鎂晶體(MgSO4·7H2O )在制革、醫藥等領域均有廣泛用途。4.92g硫酸鎂晶體受熱脫水過程的熱重曲線(固體質量隨溫度變化的曲線)如右圖所示。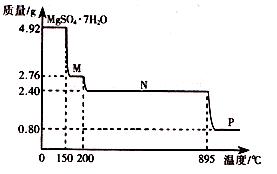
①固體M的化學式為__________。
②硫酸鎂晶體受熱失去結晶水的過程分為_________個階段。
③N轉化成P時,同時生成另一種氧化物,該反應的化學方程式為_________。
(1)① 2SO2(g) + O2(g) =" 2" SO3(g) △H =" -196.6" kJ/mol
②I.> II.810 L/mol 
(2)① MgSO4·H2O ② 2 ③ MgSO4 MgO+SO3↑
MgO+SO3↑
解析試題分析:(1)①寫出化學方程式,反應熱為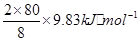 =196.6kJ·mol-1。
=196.6kJ·mol-1。
②I.生成SO3的反應是氣體體積減小的反應,恒壓條件相當于在恒容條件的基礎上再增大壓強,因此甲的轉化率高,生成的SO3多。
II.根據題意,有 2SO2 + O2 =" 2" SO3
初始量/mol: 2 1 0
變化量/mol: 2×90% 1×90% 2×90%
平衡量/mol: 0.2 0.1 1.8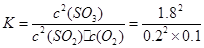 =810
=810
在該反應條件下,充入1molSO3,與原平衡是等效平衡,充入1molSO2則平衡正向移動,因此作圖時注意,平衡正向移動則正反應速率大于逆反應速率,且在原平衡的基礎上各物質的濃度都增大。
(2)①4.92g MgSO4·7H2O的物質的量為0.02mol,則M的相對分子質量為 ,因此M的分子式為MgSO4·H2O。
,因此M的分子式為MgSO4·H2O。
②根據①可知,第一階段失去6個結晶水,還剩余1個,只需要一個階段,因此共有2個階段。
③根據題意,M到N失去所有結晶水,N階段物質為MgSO4,接下來為MgSO4分解,根據題中數據,Mg的物質的量為0.02mol,則P階段的物質的相對分子質量為0.8g÷0.02mol=40g/mol,即分解產物為MgO,根據原子守恒,另一氧化物為SO3。
考點:考查熱化學方程式書寫,等效平衡,平衡常數計算,影響化學平衡的因素,化學平衡圖像,圖像分析,實驗數據處理等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:填空題
氮是地球上含量豐富的一種元素,氮元素的單質和化合物在工農業生產、生活中有重要用途。
(1)根據右下能量變化示意圖:
寫出CO和NO2反應生成NO和CO2的熱化學方程式
(2)在固定體積的密閉容器中,進行如下化學反應:N2(g)+3H2(g)  2NH3 (g) ΔH<0,
2NH3 (g) ΔH<0,
其平衡常數K與溫度T的關系如下表,試判斷K1 K2(填“>”、“=”或“<”)
| T /K | 298 | 398 |
| 平衡常數K | K1 | K2 |
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(15分)
甲醇是一種可再生能源,具有廣泛的開發和應用前景.請回答下列與甲醇有關的問題.
(1)甲醇分子是____分子(填“極性”或“非極性”).
(2)工業上一般可采用如下反應來合成甲醇:CO(g)+2H2(g) CH3OH(g)△H=-86.6kJ/mol,在T℃時,往一個體積固定為1L的密閉容器中加入1mol CO和2mol H2:,反應達到平衡時,容器內的壓強是開始時的3/5.
CH3OH(g)△H=-86.6kJ/mol,在T℃時,往一個體積固定為1L的密閉容器中加入1mol CO和2mol H2:,反應達到平衡時,容器內的壓強是開始時的3/5.
①達到平衡時,CO的轉化率為 。
②下列選項能判斷該反應達到平衡狀態的依據的有____ 。
A. | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器內的壓強保持不變 | D.混合氣體的密度保持不變 |
 (3)已知在常溫常壓下:
(3)已知在常溫常壓下:

查看答案和解析>>
科目:高中化學 來源: 題型:計算題
碳和碳的化合物在生產、生活中的應用非常廣泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一種理想,更是一種值得期待的新的生活方式。
(1)將CO2與焦炭作用生成CO,CO可用于煉鐵等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1= +489.0 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ/mol
則CO還原Fe2O3的熱化學方程式為 ;
②氯化鈀(PdCl2)溶液常被應用于檢測空氣中微量CO。PdCl2被還原成單質,反應的化學方程式為 ;
(2)將兩個石墨電極插入KOH溶液中,向兩極分別通入C3H8和O2構成丙烷燃料電池。
①負極電極反應式是: ;
②某同學利用丙烷燃料電池設計了一種電解法制取Fe(OH)2的實驗裝置(如下圖所示),通電后,溶液中產生大量的白色沉淀,且較長時間不變色。下列說法中正確的是 (填序號)
A.電源中的a一定為正極,b一定為負極
B.可以用NaCl溶液作為電解液
C.A、B兩端都必須用鐵作電極
D.陰極發生的反應是:2H++2e-=H2↑
(3)將不同量的CO(g)和H2O(g)分別通入體積為2L的恒容密閉容器中,進行反應:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三組數據:
CO2(g)+H2(g),得到如下三組數據:
| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
為減小CO2對環境的影響,在限制其排放量的同時,應加強對CO2創新利用的研究。
(1)①把含有較高濃度CO2的空氣通入飽和K2CO3溶液。②在①的吸收液中通高溫水蒸氣得到高濃度的CO2氣體。寫出②中反應的化學方程式__________________________。
(2)如將CO2與H2以1:3的體積比混合。
①適當條件下合成某烴和水,該烴是 (填序號)。
| A.烷烴 | B.烯烴 | C.炔烴 | D.苯的同系物 |
 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。測得CO2(g)和CH3OH(g)的濃度隨時間變化如圖所示。
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。測得CO2(g)和CH3OH(g)的濃度隨時間變化如圖所示。
| 溶解度(S)/g | 溶度積(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
I.高爐煉鐵是冶煉鐵的主要方法,發生的主要反應為:
Fe2O3(s) + 3CO(g) 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)已知:①Fe2O3(s) + 3C(石墨)="2Fe(s)" + 3CO(g) △H1
②C(石墨)+ CO2(g) = 2CO(g) △H2
則△H___________________(用含△H1 、△H2的代數式表示)。
(2)高爐煉鐵反應的平衡常數表達式K=____________________________。
(3)在某溫度時,該反應的平衡常數K=64,在2L恒容密閉容器甲和乙中,分別按下表所示加入物質,反應經過一段時間后達到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
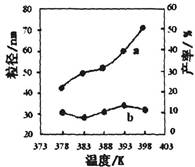
| 編號 | 溫度/K | 反應時間/h | 反應物物質的量配比 | 實驗目的 |
| ① | 378 | 4 | 3∶1 | 實驗②和④探究________ ______________________ 實驗②和__________探究 反應時間對產率的影響。 |
| ② | 378 | 4 | 4∶1 | |
| ③ | 378 | 3 | _______ | |
| ④ | 398 | 4 | 4∶1 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
除去雜質后的水煤氣主要含H2、CO,是理想的合成甲醇的原料氣。
(1)生產水煤氣過程中有以下反應:①C(s)+CO2(g) 2CO(g) △H1;
2CO(g) △H1;
②CO(g)+H2O(g) H2(g)+CO2(g) △H2;③C(s)+H2O(g)
H2(g)+CO2(g) △H2;③C(s)+H2O(g) CO(g)+H2(g) △H3;
CO(g)+H2(g) △H3;
上述反應△H3與△H1、△H2之間的關系為 。
(2)將CH4轉化成CO,工業上常采用催化轉化技術,其反應原理為:2CH4(g)+3O2(g) 4CO(g)+4H2O(g) △H=-1038kJ/mol。工業上要選擇合適的催化劑,分別對X、Y、Z三種催化劑進行如下實驗(其他條件相同):
4CO(g)+4H2O(g) △H=-1038kJ/mol。工業上要選擇合適的催化劑,分別對X、Y、Z三種催化劑進行如下實驗(其他條件相同):
①X在750℃時催化效率最高,能使正反應速率加快約3×105倍;
②Y在600℃時催化效率最高,能使正反應速率加快約3×105倍;
③Z在440℃時催化效率最高,能使逆反應速率加快約1×106倍;
根據上述信息,你認為在生產中應該選擇的適宜催化劑是 (填“X”或“Y”或“Z”),選擇的理由是 ;
(3)請在答題卡中,畫出(2)中反應在有催化劑與無催化劑兩種情況下反應過程中體系能量變化示意圖,并進行必要標注。
(4)合成氣合成甲醇的主要反應是:2H2(g)+CO(g) CH3OH(g) △H=-90.8kJ·mol-1,T℃下此反應的平衡常數為160。
CH3OH(g) △H=-90.8kJ·mol-1,T℃下此反應的平衡常數為160。
此溫度下,在密閉容器中開始只加入CO、H2,反應10min后測得各組分的濃度如下:
| 物質 | H2 | CO | CH3OH |
| 濃度/(mol·L-1) | 0.20 | 0.10 | 0.40 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某實驗小組用0.5mol/LNaOH溶液和0.5mol/L硫酸溶液反應進行中和熱的測定。
Ⅰ.配制0.5mol/LNaOH溶液。
(1)若實驗中大約要使用245mlNaOH溶液,至少需要稱量NaOH固體 g。
(2)從下列儀器中選擇稱量NaOH固體所需的儀器(填字母) 。
a.托盤天平(帶砝碼)b.小紙片c.小燒杯d.坩堝鉗 e.玻璃棒 f.藥匙 g.量筒
Ⅱ.測定稀硫酸和稀氫氧化鈉中和熱的實驗裝置如圖所示: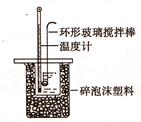
(1)寫出該反應的用中和熱表示的熱化學方程式(中和熱為57.3kJ/mol) 。
(2)取50mlNaOH溶液和30ml硫酸溶液進行實驗,實驗數據如表所示。
①請填寫表中的空白:
| 溫度 實驗次數 | 起始溫度t1/℃ | 終止溫度 t2/℃ | 溫度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
一定條件下密閉容器中發生如下反應:N2(g)+3H2(g)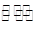 2NH3(g),能說明該反應達到化學平衡狀態的是 ( )
2NH3(g),能說明該反應達到化學平衡狀態的是 ( )
| A.N2、H2、NH3的濃度相等 |
| B.N2、H2、NH3的濃度不再變化 |
| C.N2、H2、NH3在密閉容器中共存 |
| D.反應停止,正、逆反應速率都等于零 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com