
【題目】下列關系圖中,A是一種正鹽,B是氣態氫化物,C是單質,F是強酸。當X無論是強酸還是強堿時都有如下轉化關系(其他反應產物及反應所需條件均已略去)。當X是強堿時, B能使濕潤的紅色石蕊試紙變藍。下列說法中不正確的是
![]()
A. 當X是強酸時,A、B、C、D、E、F中均含同一種元素,F可能是H2SO4
B. 當X是強堿時,A、B、C、D、E、F中均含同一種元素,F是HNO3
C. B和Cl2的反應是氧化還原反應
D. 當X是強酸時,C在常溫下是氣態單質
科目:高中化學 來源: 題型:
【題目】已知幾種元素的性質或原子結構的相關敘述如表所示。
元素 | 元素性質或原子結構的相關敘述 |
T | 失去1個電子后,形成與Ne相同的核外電子排布 |
X | 最外層電子數是次外層電子數的2倍 |
Y | 其某種單質是空氣的主要成分,也是最常見的助燃劑 |
Z | 原子核外有3個電子層,最外層比次外層少1個電子 |
回答下列問題:
(1)元素X的一種同位素用作相對原子質量的標準,這種同位素的原子符號是________。
(2)Y形成的另一種單質主要存在于地球的平流層中,被稱作地球生物的保護傘,該單質的化學式是________。
(3)元素Z在海水中含量非常高,海水中含Z元素的化合物主要是__________(寫化學式)。
(4)畫出T原子的結構示意圖:____________。
(5)T元素組成的單質在Y元素組成的常見單質中燃燒,得到的產物是________(填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C、N、S的氧化物常會造成一些環境問題,科研工作者正在研究用各種化學方法來消除這些物質對環境的影響。
(1)目前工業上有一種方法是用CO,和H2在230℃,催化劑條件下轉化生成甲醇蒸汽和水蒸氣。
圖一表示恒壓容器中0.5molCO2和1.5molH2轉化率達80%時的能量變化示意圖。寫出該反應的熱化學方程式_____________。
(2) “亞硫酸鹽法”吸收煙氣中的SO2。室溫條件下,將煙氣通入(NH4)2SO4溶液中,測得溶液pH與含硫組分物質的量分數的變化關系如圖二所示。

請寫出a點時n(HSO3-):n(H2SO3)=______,b點時溶液pH=7,則n(NH4+):n(HSO3-)=___。
(3)催化氧化法去除NO,一定條件下,用NH3消除NO污染,其反應原理為4NH3+6NO![]() 5N2+ 6H2O。不同溫度條件下,n(NH3):n(NO)的物質的量之比分別為4:l、3:l、1:3時,得到NO脫除率曲線如圖三所示:
5N2+ 6H2O。不同溫度條件下,n(NH3):n(NO)的物質的量之比分別為4:l、3:l、1:3時,得到NO脫除率曲線如圖三所示:
① 請寫出N2的電子式________。
② 曲線c對應NH3與NO的物質的量之比是______。
③ 曲線a中NO的起始濃度為6×10-4mg/m3,從A點到B點經過0.8s,該時間段內NO的脫除速率為_____mg/(m3·s)。
(4)間接電化學法可除NO。其原理如圖四所示,寫出電解池陰極的電極反應式(陰極室溶液呈酸性):_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】圖示為含同一種元素的a、b、c、d、e五種物質的轉化關系.其中a是單質,b是氣態氫化物,c、d是氧化物,e是該元素最高價氧化物對應水化物,則a不可能是(已知CH4高溫時可發生分解生成C、H2)

①F2 ②N2 ③C ④S
A. 只有①B. ②和④C. ③和④D. ①和③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸是化工行業廣泛應用的基礎原料,某化學興趣小組為探究濃硫酸所具有的一些特殊性質,進行如下有關實驗。
實驗一:濃硫酸與銅反應
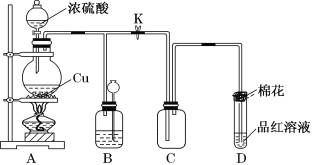
(1)裝置A中發生反應的化學方程式為_____________________________;當反應轉移0.2mol電子時,生成氣體在標況下的體積為_________L。
(2)裝置D中試管口放置的棉花浸有NaOH濃溶液,其作用是______________;
(3)裝置B的作用是貯存多余的氣體。當D處有明顯的現象后,關閉旋塞K,移去酒精燈,但由于余熱的作用,A處仍有氣體產生,此時B中由于氣壓增大引發的現象是________________,B中應放置的溶液是________。
A 水 B 酸性KMnO4溶液 C 濃溴水 D 飽和NaHSO3溶液
實驗二:濃硫酸與碳反應,并驗證反應生成的氣體產物
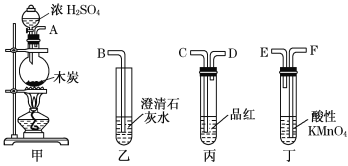
(4)馮同學認為按照甲、丙、丁、乙的裝置順序,即可驗證產物為SO2和CO2,那么丁中酸性KMnO4溶液的作用是______________;
(5)陳同學認為丙裝置要使用兩次才能確保檢驗氣體產物的準確性,如按該同學所說,氣流由左向右流向,連接上述裝置的正確順序是(填各接口字母):A——________________________________________——B;能說明氣體產物中有CO2的實驗現象是①__________________②____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由幾種離子化合物組成的混合物,含有以下離子中的若干種:K+、Cl、NH4+、Mg2+、CO32、Ba2+、SO42。將該混合物溶于水后得澄清溶液,現取3份100mL該溶液分別進行三組實驗,實驗內容和結果如下表所示:
實驗序號 | 實驗內容 | 實驗結果 |
1 | 加AgNO3溶液 | 有白色沉淀生成 |
2 | 加足量NaOH溶液并加熱 | 收集到氣體1.12L(已折算成標準狀況下的體積) |
3 | 加入足量BaCl2溶液,對所得沉淀進行洗滌、干燥、稱量;再向沉淀中加足量稀鹽酸,然后對剩余沉淀進行洗滌、干燥、稱量 | 第一次稱量讀數為6.27g 第二次稱量讀數為2.33g |
根據實驗判斷,下列說法正確的是( )
A. 該溶液中一定含有的陽離子是K+、NH4+
B. 該溶液中一定不含的離子是Ba2+、Mg2+、Cl
C. 無法確定是否含有的離子是K+、Cl
D. 向實驗3所得沉淀中加入鹽酸時所發生反應的離子方程式為CO32 + 2H+ = H2O + CO2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表的一部分,請參照元素①~⑨在表中的位置,用化學用語回答下列問題:
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)這九種元素中,位于第三周期且原子半徑最小元素的原子結構示意圖_____________。
(2)④、⑤、⑧三種元素中,離子半徑由大到小的順序為__________(填離子符號)。
(3)②、⑦、⑧的最高價含氧酸的酸性由強到弱的順序是
⑧和⑨元素的氣態氫化物穩定性順序為_____________________(填化學式)。
(4)⑥單質與⑤的最高價氧化物的水化物反應的離子方程式為____________________________。
(5)①、④、⑤、⑨四種元素中,某些元素間可形成既含離子鍵又含極性共價鍵的化合物,寫出其中一種化合物的電子式____________。
(6)元素⑤與元素④能形成原子個數比為1:1的化合物Y,Y在常溫下為固態,焰色反應為黃色,Y與②的最高價氧化物反應的化學方程式為_____________,②的最高價氧化物的電子式___________。
(7)能說明⑧的非金屬性比⑨的非金屬性__________(填“強”或“弱”)的事實是________(用離子方程式說明)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸亞鐵銨[(NH4)2Fe(SO4)2)]是分析化學中的重要試劑,在隔絕空氣加熱至500℃時能完全分解,分解產物中含有鐵氧化物、硫氧化物、氨氣和水蒸氣等。某化學小組選用下圖所示裝置進行實驗(夾持裝置略),探究此反應產物。

(1)甲同學根據可能生成的氣體產物,設計下列實驗:
操作步驟 | 實驗現象 | 結論或解釋 |
①按______________的順序組裝儀器并進行實驗 | ②___________ | 氣體產物中既有H2O ,也有NH3 |
③按A、C、D、E的順序組裝儀器并進行實驗,其中裝置C的作用是____________ | C中無明顯現象,D中生成白色沉淀 | ④D中發生反應的離子方程式為___________ |
(2)乙同學稱取14.20g硫酸亞鐵銨固體,隔絕空氣加熱至500℃ 時使其完全分解,冷卻后稱得固體質量為4.00g,則所得固體產物的化學式為_____。(硫酸亞鐵銨的摩爾質量為284g·mol-1)
(3)實驗證明:(NH4)2Fe(SO4)2受熱分解除生成上述產物外,還有N2生成,寫出硫酸亞鐵銨在隔絕空氣的條件下加熱至500℃時的分解反應方程式_____________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com