
【題目】X、Y、Z、R、M是原子序數依次增大的五種元素,基態(tài)X原子的2p電子數是2s電子數的一半,由Y、Z元素組成的某種化合物是一種常用的漂白劑、供氧劑,Z和R位于同周期且R的基態(tài)原子中有3個電子能量最高,M2+與過量氨水作用,先得到藍色沉淀后轉化為深藍色溶液Q。請回答下列問題:
(1)Z、R、M三種元素的第一電離能由大到小的順序為________(用元素符號表示)。
(2)XCl3、RCl3兩種分子中屬于非極性分子的是_______ (填化學式)。
(3)已知H2Y2和RH3的相對分子質量相同,H2Y2的熔點為-0.43℃,沸點為158℃,而RH3的熔點為-133℃,沸點為-87.7℃,其主要原因是_________。
(4)X、R元素可形成一種具有立體網狀結構的化合物,其晶胞結構如圖所示,該化合物的晶體類型是______,化學式為________,X的配位數是________。

【答案】P>Cu>Na BCl3 兩種物質均是分子晶體,H2O2分子間存在氫鍵而PCl3分子間不存在氫鍵 原子晶體 BP 4
【解析】
X、Y、Z、R、M五種元素的原子序數依次增大,基態(tài)X原子的2p電子數是2s電子數的一半,原子核外電子排布為1s22s22p1,則X為B元素;由Y、Z元素組成的一種化合物是一種常用的漂白劑、供氧劑,則Y為O元素、Z為Na;Z和R位于同周期且R的基態(tài)原子中有3個電子能量最高,外圍電子排布使為3s23p3,故R為P元素;M2+與過量氨水作用先得到藍色沉淀后轉化為深藍色溶液Q,則M為Cu。
(1)元素的非金屬性越強,第一電離能越大,金屬性越強,第一電離能越小;
(2)化合物BCl3的B原子孤電子對數為0,雜化軌道數目為3,為平面正三角形,而PCl3中P原子由1對孤對電子,價層電子對數為4,為三角錐形;
(3)H2O2分子之間形成氫鍵,熔沸點較高;
(4) 具有立體網狀結構的化合物的晶體類型為原子晶體;根據均攤法計算晶胞中原子數目,確定化學式;R原子配位數為4,晶體中原子配位數與原子數目呈反比。
根據上述分析可知:X為B元素;Y為O元素、Z為Na元素;R為P元素;M為Cu元素。
(1)Z、R、M三種元素分別是Na、P、Cu,由于元素的非金屬性越強,其第一電離能越大,元素的金屬性越強,第一電離能越小,所以第一電離能由大到小的順序為:P>Cu>Na,
(2)化合物BCl3的B原子孤電子對數為0,雜化軌道數目為3,B原子采取sp2雜化,為平面正三角形,分子中正負電荷重心重合,屬于非金屬性分子;而PCl3中P原子有1對孤對電子,價層電子對數為4,為三角錐形,分子中正負電荷重心不重合,屬于極性分子;
(3)H2O2分子之間除存在分子間作用力外,還存在氫鍵;而PH3分子之間只存在分子間作用力,不能形成氫鍵,故H2O2熔沸點較高;
(4)X、R元素分別是B、P,二者可形成一種具有立體網狀結構的化合物,則該晶體為原子晶體,由其晶胞結構可知,在該晶胞中含有的B原子數為8×![]() =4,晶胞中P原子數目為4,所以該化合物的化學式為BP,R原子配位數為4,晶體中R、X原子數目之比為1:1,故二者配位數相等,則X的配位數是4。
=4,晶胞中P原子數目為4,所以該化合物的化學式為BP,R原子配位數為4,晶體中R、X原子數目之比為1:1,故二者配位數相等,則X的配位數是4。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】某相對分子質量小于200的芳香族含氧衍生物中氧的質量分數約為13.1%(僅含碳、氫、氧三種元素),已知其分子中含有2個-CH3,且該物質遇FeCl3溶液顯紫色,則該有機物的結構式共有
A. 2種B. 4種C. 6種D. 8種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列反應的熱化學方程式為
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
則反應2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH為( )
A.-488.3kJ·mol-1
B.-191kJ·mol-1
C.-476.8kJ·mol-1
D.-1549.6kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的轉化在給定條件下均能通過一步反應實現的是
A. NaAlO2(aq)![]() AlCl3
AlCl3![]() Al2O3
Al2O3
B. N2![]() NO2
NO2![]() HNO3
HNO3
C. NaCl(飽和)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
D. FeS2![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學一選修5:有機化學基礎](15分)聚戊二酸丙二醇酯(PPG)是一種可降解的聚酯類高分子材料,在材枓的生物相容性方面有很好的應用前景。 PPG的一種合成路線如下:
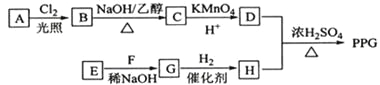
已知:
①烴A的相對分子質量為70,核磁共振氫譜顯示只有一種化學環(huán)境的氫;
②化合物B為單氯代烴:化合物C的分子式為C5H8;
③E、F為相對分子質量差14的同系物,F是福爾馬林的溶質;
④![]() 。
。
回答下列問題:
(1)A的結構簡式為 。
(2)由B生成C的化學方程式為 。
(3)由E和F生成G的反應類型為 ,G的化學名稱為 。
(4)①由D和H生成PPG的化學方程式為 。
②若PPG平均相對分子質量為10000,則其平均聚合度約為 (填標號)。
a.48 b.58 c.76 d.122
(5)D的同分異構體中能同時滿足下列條件的共有 種(不含立體異構):
①能與飽和NaHCO3溶液反應產生氣體
②既能發(fā)生銀鏡反應,又能發(fā)生皂化反應
其中核磁共振氫譜顯示為3組峰,且峰面積比為6:1:1的是 (寫結構簡式):
D的所有同分異構體在下列—種表征儀器中顯示的信號(或數據)完全相同,該儀器是_____(填標號)。
a.質譜儀 b.紅外光譜儀 c.元素分析儀 d.核磁共振儀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能證明碳酸的酸性比硅酸強的事實是
A. 二氧化碳溶于水且能反應生成碳酸,二氧化硅不溶于水不能與水反應生成硅酸
B. 在高溫下,二氧化硅與碳酸鈉能發(fā)生反應:SiO2+Na2CO3![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
C. 二氧化硅的熔點比二氧化碳的熔點高
D. 二氧化碳通入硅酸鈉溶液中,生成白色膠狀沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校化學興趣小組根據反應 H2O2+2HI=2H2O+I2 探究影響化學反應速率的因素。實驗數據如下
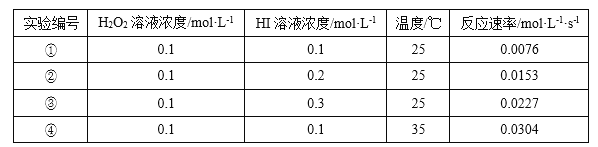
回答下列問題:
(1)反應 H2O2+2HI=2H2O+I2 中,氧化劑是_____。
(2)25℃時,表明增大反應物濃度,化學反應速率_____(填“增大”成“減小”)。
(3)能表明溫度對化學反應速率影響的實驗編號是①和_____。
(4)H2O2 不穩(wěn)定,寫出 H2O2 發(fā)生分解反應的化學方程式:_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學反應中,屬于氧化還原反應的是
A. CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ B. KCl+AgNO3=AgCl↓+KNO3
C. 4NH3+5O2![]() 4NO+6H2O D. CaCO3
4NO+6H2O D. CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ 有機物具有廣泛的用途。現有下列有機物:①乙烯 ②1,3-丁二烯 ③甲醛 ④油脂。請將相應的序號填入空格內。
(1)能用于制備肥皂的是_________;
(2)能用于制備聚乙烯塑料的是_________;
(3)能用于制備順丁橡膠的是____________;
(4)能用于制備酚醛樹脂的是____________。
Ⅱ.按要求回答下列問題:
(1) 名稱為____________。
名稱為____________。
(2)A,B,C三種烴的化學式均為C6H10,它們的分子中均無支鏈或側鏈。
①若A為環(huán)狀,則其結構簡式為________。
②若B為含有雙鍵的鏈狀結構,且分子中不存在“![]() ”基團,則其可能的結構簡式為__________(任寫一種)。
”基團,則其可能的結構簡式為__________(任寫一種)。
③若C為含有三鍵的鏈狀結構,則其可能的結構簡式及名稱為___________。
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com