
【題目】![]() 是一種常見的強氧化劑,主要用于防腐、化工、制藥等。現以某種軟錳礦
是一種常見的強氧化劑,主要用于防腐、化工、制藥等。現以某種軟錳礦![]() 主要成分
主要成分![]() ,還有
,還有![]() 、
、![]() 、
、![]() 等
等![]() 作脫硫劑,通過如下簡化流程既脫除燃煤尾氣中的
作脫硫劑,通過如下簡化流程既脫除燃煤尾氣中的![]() ,又制得
,又制得![]() 反應條件已經省略
反應條件已經省略![]() 。
。
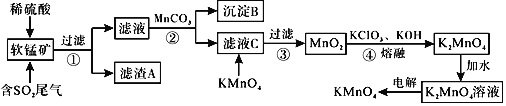
已知:![]() ,
,![]() 回答下列問題:
回答下列問題:
![]() 濾渣A的成分是
濾渣A的成分是![]() 寫化學式
寫化學式![]() ______。
______。
![]() 析出沉淀B時,首先析出的物質是
析出沉淀B時,首先析出的物質是![]() 寫化學式
寫化學式![]() ______。
______。
![]() 步驟2中加入
步驟2中加入![]() 的作用為______。
的作用為______。
![]() 濾液C中加入
濾液C中加入![]() 時發生反應的離子方程式是______。
時發生反應的離子方程式是______。
![]() 完成步驟4中反應的化學方程式______
完成步驟4中反應的化學方程式______![]() ______
______![]() ______
______![]() ______
______
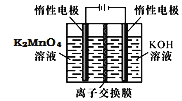
![]() 電解制備
電解制備![]() 的裝置如圖所示。電解液中最好選擇______離子交換膜
的裝置如圖所示。電解液中最好選擇______離子交換膜![]() 填“陽”或“陰”
填“陽”或“陰”![]() 。電解時,陽極的電極反應式為______。
。電解時,陽極的電極反應式為______。
【答案】![]()
![]() 調節溶液的pH,促進
調節溶液的pH,促進![]() 、
、![]() 水解以沉淀形式除去
水解以沉淀形式除去 ![]() 3 6 3
3 6 3 ![]() 陽
陽 ![]()
【解析】
向軟錳礦![]() 主要成分
主要成分![]() ,還有
,還有![]() 、
、![]() 、
、![]() 等
等![]() 通入含有
通入含有![]() 的尾氣,同時加入稀硫酸:
的尾氣,同時加入稀硫酸:![]() 、
、![]() 、
、![]() ,
,![]() 不溶,過濾,濾渣A為
不溶,過濾,濾渣A為![]() ,濾液中含有的金屬離子為:
,濾液中含有的金屬離子為:![]() 、
、![]() 、
、![]() ,加入
,加入![]() 調節溶液的pH,促進
調節溶液的pH,促進![]() 、
、![]() 水解以沉淀形式除去,沉淀B為
水解以沉淀形式除去,沉淀B為![]() 和
和,濾液C就主要含有
![]() ,加入
,加入![]() 時發生價態歸中反應:
時發生價態歸中反應:![]() ,過濾得到
,過濾得到![]() ,與
,與![]() 和KOH熔融反應:
和KOH熔融反應:![]() ,得到
,得到![]() ,加水溶液得到溶液,電解
,加水溶液得到溶液,電解![]() 溶液得到產品
溶液得到產品![]() ,據此分析作答。
,據此分析作答。
![]() 軟錳礦中
軟錳礦中![]() 不溶于酸,過濾,濾渣A為
不溶于酸,過濾,濾渣A為![]() ;
;
故答案為:![]() ;
;
![]() 經過分析可知沉淀B為
經過分析可知沉淀B為![]() 和
和![]() ,已知:
,已知:![]() ,
,![]() ,
,![]() 的溶解度更小,先沉淀;
的溶解度更小,先沉淀;
故答案為:![]() ;
;
![]() 步驟2中加入
步驟2中加入![]() 的作用為調節溶液的pH,促進
的作用為調節溶液的pH,促進![]() 、
、![]() 水解以沉淀形式除去;
水解以沉淀形式除去;
故答案為:調節溶液的pH,促進![]() 、
、![]() 水解以沉淀形式除去;
水解以沉淀形式除去;
![]() 濾液C主要含有
濾液C主要含有![]() ,加入
,加入![]() 時發生價態歸中反應:
時發生價態歸中反應:![]() ;
;
故答案為:![]() ;
;
![]() 通過流程可知步驟4中反應為
通過流程可知步驟4中反應為![]() 與
與![]() 和KOH熔融生成
和KOH熔融生成![]() 的反應,方程式為:
的反應,方程式為:![]() ;
;
故答案為:3;6;3;![]() ;
;
![]() 陽極為
陽極為![]() 溶液,陽極失去電子發生氧化反應,為
溶液,陽極失去電子發生氧化反應,為![]() ,說明
,說明![]() 在陽極生成,則應為陽離子交換膜;
在陽極生成,則應為陽離子交換膜;
故答案為:陽;![]() 。
。


科目:高中化學 來源: 題型:
【題目】聚合硫酸鐵(PFS)是水處理中重要的絮凝劑,以廢鐵屑為原料制備PFS的具體工藝流程如下:

下列說法錯誤的是
A. 步驟①,粉碎的目的是為了增大反應物接觸面積,提高“酸浸”反應速率
B. 步驟④,加稀硫酸調節pH在一定的范圍內,讓Fe3+部分水解形成堿式鹽
C. 步驟⑤,減壓蒸發,有利于降低水的沸點防止產物分解
D. 步驟③,可以選擇雙氧水、氯氣等氧化劑將Fe2+轉化成Fe3+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸鹽在生產、生活中有重要作用。重晶石是_____(寫化學式),可作白色顏料、醫療上“鋇餐”;膽礬是_______(寫化學式),加熱膽礬發生的反應方程式是_______;明礬是______(寫化學式),其電離方程式是_______,常用作凈水劑。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向如圖所示的裝置中緩慢地通入適量Cl2后,有色布條褪色。則X中所加物質可能是

A. 飽和食鹽水
B. 濃硫酸
C. NaOH溶液
D. FeCl2 溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,當反應達到平衡時,下列措施:①升溫 ②恒容通入稀有氣體 ③增加CO濃度 ④減壓 ⑤加催化劑 ⑥恒壓通入稀有氣體,能提高COCl2轉化率的是( )
CO(g)+Cl2(g) ΔH>0,當反應達到平衡時,下列措施:①升溫 ②恒容通入稀有氣體 ③增加CO濃度 ④減壓 ⑤加催化劑 ⑥恒壓通入稀有氣體,能提高COCl2轉化率的是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】閃電時空氣中有臭氧生成。下列說法正確的是( )
A.![]() 和
和![]() 互為同位素
互為同位素
B.![]() 與
與![]() 的相互轉變是物理變化
的相互轉變是物理變化
C.相同狀況下,等體積![]() 和
和![]() 含有相同質子數
含有相同質子數
D.![]() 比
比![]() 氧化性更強
氧化性更強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】回答下列問題:
(1)有一種溶液除H+、OH-外,還有Na+、SO![]() 和Cl-,測得三種離子的濃度分別是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,該溶液的pH為________。
和Cl-,測得三種離子的濃度分別是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,該溶液的pH為________。
(2)NH4Cl溶液顯酸性,試用離子方程式表示這一原理______________________。
(3)液氨的電離類似于水,試寫出液氨的電離方程式________________________________ ;在液氨中加入NH4Cl,平衡將向________移動。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,某容積恒定的密閉容器中發生如下可逆反應:
CO(g)+H2O(g)![]() H2(g)+CO2(g)△H>0。當反應達平衡時,測得容器中各物質均為n mol,欲使H2的平衡濃度增大一倍,在其它條件不變時,下列措施可以采用的是
H2(g)+CO2(g)△H>0。當反應達平衡時,測得容器中各物質均為n mol,欲使H2的平衡濃度增大一倍,在其它條件不變時,下列措施可以采用的是
A.升高溫度 B.加入催化劑
C.再加入n molCO和n molH2O D.再加入2n molCO2和2n molH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮的氧化物NO3是常見的大氣污染物,化學上采用NH3處理NxOy不僅可以消除污染,還可作為工業生產的能量來源。
(1)已知:I.2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
II.4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1253.4kJ/mol
則用NH3處理NO生成氮氣和氣態水的熱化學方程式為__________________。
(2)已知:N2(g)+3H2(g) ![]() 2NH3(g)△H<0。不同溫度下,向三個一樣的容器中投入相同的反應物進行反應,測得不同壓強下平衡混合物中NH3的物質的量分數如圖所示。
2NH3(g)△H<0。不同溫度下,向三個一樣的容器中投入相同的反應物進行反應,測得不同壓強下平衡混合物中NH3的物質的量分數如圖所示。

①M點的v正_________Q點的v正(填“>”“<”或“=”),原因是________________________。
②維持10MPa、T3℃的條件不變,要提高H2的轉化率,可以采取的措施是__________________(任寫一條)。
③圖中三條曲線對應的溫度T1、T2、T3由高到低的順序為__________________。
④恒溫恒容條件下,能說明反應N2(g)+3H2(g) ![]() 2NH3(g)達到平衡狀態的是_________(填選項字母)
2NH3(g)達到平衡狀態的是_________(填選項字母)
A.c2(NH3)/[c(N2 )c3(H2)]保持不變
B.3mol H-H鍵斷裂的同時,有2mol N-H鍵斷裂
C.2v(N2)=v(NH3)
D.反應器中的壓強不再發生變化
⑤T3溫度下,將1molN2和3molH2充入2L的密閉容器中,維持壓強為60MPa不變,達到N點的平衡狀態,反應的濃度平衡常數Kc=_____________ (mol/L)-2(用最簡分數表示),M點的平衡常數比N點的平衡常數_________(填“大”“小”或“相等”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com