
【題目】電子工業上使用![]() 溶液蝕刻銅箔制造印刷電路板。在該制備工藝中,為了實現資源再生,減少污染,某興趣小組提出廢液處理和資源回收的過程如下:
溶液蝕刻銅箔制造印刷電路板。在該制備工藝中,為了實現資源再生,減少污染,某興趣小組提出廢液處理和資源回收的過程如下:
Ⅰ.向廢液中投入過量鐵屑,充分反應后分離出固體和濾液;
Ⅱ.向濾液中加入一定量石灰水,調節溶液![]() ,同時鼓入足量的空氣。
,同時鼓入足量的空氣。
已知:Ksp[Fe(OH)3]=4×10-38,回答下列問題:
(1)![]() 蝕刻銅箔反應的離子方程式為______;過程Ⅰ加入鐵屑的主要作用是______
蝕刻銅箔反應的離子方程式為______;過程Ⅰ加入鐵屑的主要作用是______
(2)過程Ⅱ中鼓入足量的空氣發生反應的化學方程式為______
(3)過程Ⅱ中調節溶液的![]() 為5,金屬離子濃度為______。(列式計算)
為5,金屬離子濃度為______。(列式計算)
(4)另一興趣小組將制造印刷電路板![]() 蝕刻銅箔的反應設計成一個原電池。請將方框中實驗裝置圖補充完整,并作相應標注(標出電極材料、電解質溶液)。限選材料:
蝕刻銅箔的反應設計成一個原電池。請將方框中實驗裝置圖補充完整,并作相應標注(標出電極材料、電解質溶液)。限選材料:![]() ,
,![]() ,
,![]() ,
,![]() :銅片,鐵片,鋅片,石墨和導線。
:銅片,鐵片,鋅片,石墨和導線。
(5)廢舊印刷電路板經粉碎分離能得到非金屬粉末和金屬粉末,也可回收利用實現資源再生,減少污染。印刷電路板的金屬粉末用![]()
![]() 和
和![]()
![]() 的混合溶液處理,溶出印刷電路板金屬粉末中的銅。控制其他條件相同時,測得不同溫下銅的平均溶解速率(見下表)。
的混合溶液處理,溶出印刷電路板金屬粉末中的銅。控制其他條件相同時,測得不同溫下銅的平均溶解速率(見下表)。
溫度 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
銅平均溶解速率 |
|
|
|
|
|
|
|
①當溫度高于![]() 時,銅的平均溶解速率隨著反應溫度升高而下降,其主要原因是______。
時,銅的平均溶解速率隨著反應溫度升高而下降,其主要原因是______。
②在提純后的![]() 溶液中加入一定量的
溶液中加入一定量的![]() 和
和![]() 溶液,加熱,生成
溶液,加熱,生成![]() 沉淀。制備
沉淀。制備![]() 的離子方程式是______。
的離子方程式是______。
【答案】2Fe3++Cu=2Fe2++Cu2+ 回收金屬銅 4Fe(OH)2+O2+2H2O=4Fe(OH)3 c(Fe3+)=Ksp[Fe(OH)3]/c3(OH-)=4×10-38/10-27=4×10-11 mol/L 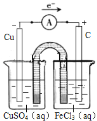 雙氧水分解速率加快 2Cu2++2Cl-+SO32-+H2O=2CuCl↓+SO42-+2H+
雙氧水分解速率加快 2Cu2++2Cl-+SO32-+H2O=2CuCl↓+SO42-+2H+
【解析】
(1)鐵離子和銅發生氧化還原反應,據此寫出反應的離子方程式;廢液含有亞鐵離子和銅離子等,過程Ⅰ加入鐵屑把廢液中的銅離子置換出來,回收金屬銅;
(2)氫氧化亞鐵易被空氣中的氧氣氧化成氫氧化鐵,據此寫出反應的方程式;
(3)pH=5,c(H+)=10-5mol/L,c(OH-)=10-9mol/L,根據Ksp[Fe(OH)3]=c3(OH-)·c(Fe3+)代入數值進行計算;
(4)2FeCl3+Cu=2FeCl2+CuCl2,該反應為氧化還原反應,石墨做正極材料,氯化鐵在正極發生還原反應;銅在負極發生氧化反應,電解質溶液為硫酸銅;據此完成裝置圖;
(5)①溫度過高,雙氧水分解速率加快;
②根據題給信息寫該反應的離子方程式。
(1)鐵離子和銅發生氧化還原反應,離子方程式為:2Fe3++Cu=2Fe2++Cu2+;廢液含有亞鐵離子和銅離子等,過程Ⅰ加入鐵屑把廢液中的銅離子置換出來,回收金屬銅;
綜上所述,本題答案是:2Fe3++Cu=2Fe2++Cu2+;回收金屬銅。
(2)濾液中的亞鐵離子與OH-反應,生成氫氧化亞鐵,氫氧化亞鐵易被空氣中的氧氣氧化成氫氧化鐵,所以過程Ⅱ中鼓入足量的空氣發生反應的化學方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
綜上所述,本題答案是:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)pH=5,c(H+)=10-5mol/L,c(OH-)=10-9mol/L,根據Ksp[Fe(OH)3]=c3(OH-)·c(Fe3+)=4×10-38,c(Fe3+)= Ksp[Fe(OH)3]/ c3(OH-)=4×10-38/10-27=4×10-11 mol/L;
綜上所述,本題答案是:c(Fe3+)=Ksp[Fe(OH)3]/c3(OH-)=4×10-38/10-27=4×10-11 mol/L 。
(4)2FeCl3+Cu= 2FeCl2+CuCl2,該反應為氧化還原反應,氯化鐵發生還原反應,銅發生氧化反應;因此,根據圖示裝置可知,左側燒杯加入硫酸銅溶液,電極為銅,銅在此極發生氧化反應:Cu﹣2e﹣=Cu2+ ,電解質溶液為硫酸銅;右側燒杯中加入氯化鐵溶液,電極材料為石墨,電解質溶液為氯化鐵,鐵離子在此極得電子還原為亞鐵離子,極反應為:Fe3++e﹣=Fe2+具體裝置圖如下: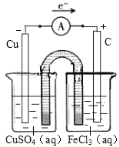 ;
;
綜上所述,本題答案是: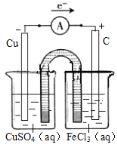 。
。
(5)①根據測得不同溫度下銅的平均溶解速率的數據,會發現隨著溫度的升高,銅的平均溶解速率,當溫度高于40℃時,銅的平均溶解速率隨著反應溫度升高而下降,因為雙氧水受熱易分解,導致金屬銅的反應速率減慢;
綜上所述,本題答案是:雙氧水分解速率加快。
②根據題給信息可知該反應的離子方程式是:2Cu2++2Cl-+SO32-+H2O=2CuCl↓+SO42-+2H+;
綜上所述本題答案是:2Cu2++2Cl-+SO32-+H2O=2CuCl↓+SO42-+2H+。


 A加金題 系列答案
A加金題 系列答案 全優測試卷系列答案
全優測試卷系列答案科目:高中化學 來源: 題型:
【題目】標出下列氧化還原反應的電子轉移數目和方向,并寫出氧化劑
(1)2K2S + K2SO3 + 3H2SO4= 3K2SO4 + 3S↓+ 3H2O _______氧化劑_______
(2)2KMnO4 +5H2O2 + 3H2SO4 = K2SO4+2MnSO4+5O2↑ + 8H2O _______ 氧化劑_______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列溶液中微粒的物質的量濃度關系正確的是
A. 25 ℃時,向0.1 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH)>c(SO![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
B. 25 ℃時,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol·L-1
C. 0.1![]()
![]() 溶液:
溶液:![]()
D. 相同物質的量濃度的CH3COONa和NaClO的混合液中,各離子濃度的大小關系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種新型錳氫二次電池原理如圖所示。該電池以MnSO4溶液為電解液,碳纖維與Pt/C分別為電極材料,電池的總反應為Mn2++ 2H2O![]() MnO2 + 2H++ H2↑。下列說法錯誤的是
MnO2 + 2H++ H2↑。下列說法錯誤的是
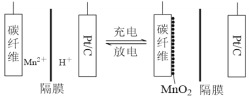
A. 充電時,碳纖維電極做陽極
B. 充電時,碳纖維電極附近溶液的pH增大
C. 放電時,電子由Pt/C電極經導線流向碳纖維電極
D. 放電時,正極反應式為MnO2 + 4H++ 2e-=Mn2++ 2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,兩種碳酸鹽![]() ,(
,(![]() 分別為Ca2+和Ba2+兩種離子)的沉淀溶解平衡曲線如圖所示。已知:
分別為Ca2+和Ba2+兩種離子)的沉淀溶解平衡曲線如圖所示。已知:![]() ,
,![]() 。已知
。已知![]() 比
比![]() 溶解度更大(不考慮陰離子的水解)。下列說法正確的是
溶解度更大(不考慮陰離子的水解)。下列說法正確的是
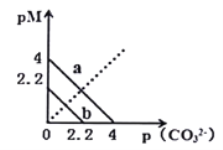
A. 向![]()
![]() 的
的![]() 溶液中加入固體
溶液中加入固體![]() ,當加入
,當加入![]() 固體的質量為
固體的質量為![]() 時,
時,![]() 恰好沉淀完全(離子濃度為
恰好沉淀完全(離子濃度為![]() 時認為沉淀完全;忽略溶液體積變化)
時認為沉淀完全;忽略溶液體積變化)
B. ![]() 的
的![]()
C. 該溫度下,向![]() 的飽和溶液中加入
的飽和溶液中加入![]() 溶液,一定能產生沉淀
溶液,一定能產生沉淀
D. 線![]() 表示
表示![]() 的溶解平衡曲線
的溶解平衡曲線
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用0.100 0 mol![]() L-1的NaOH溶液滴定20.00 mL未知濃度的某酸HX,滴定曲線如圖所示。下列說法正確的是
L-1的NaOH溶液滴定20.00 mL未知濃度的某酸HX,滴定曲線如圖所示。下列說法正確的是

A. 滴定過程可用甲基橙作指示劑
B. 常溫下,HX的電離常數約為1×10-5
C. 點d溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
D. 點b溶液中:c(HX) + c(H+)=c(OH-) + c(X-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物A是基本有機化工原料,由A合成高分子化合物C和![]() 的合成路線如下圖(部分反應條件略去):
的合成路線如下圖(部分反應條件略去):

已知:①R-CN![]() R-COOH
R-COOH
②![]()
回答下列問題:
(1)A的化學名稱是____________。
(2)C分子中所含官能團的名稱是____________;D的結構簡式是____________。
(3)B![]() C和G
C和G![]() H的反應類型分別是____________、____________。
H的反應類型分別是____________、____________。
(4)A![]() E的化學方程式是_________________________________________。
E的化學方程式是_________________________________________。
(5)F![]() G的化學方程式是_________________________________________。
G的化學方程式是_________________________________________。
(6)B的同分異構體中,與B具有相同的官能團且能發生銀鏡反應的共有________種(不含立體異構);其中某種同分異構體M與H2加成的產物(C5H10O2)的核磁共振氫譜有4組峰,且峰面積比為6∶2∶1∶1,則M的結構簡式是______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某可逆反應m A(g)+n B(g) ![]() p C(g) △H,在密閉容器中進行,下圖表示在不同反應時間t 時溫度T和壓強P與反應物B在混合氣體中的百分含量B%的關系曲線。由曲線分析,下列判斷正確的是
p C(g) △H,在密閉容器中進行,下圖表示在不同反應時間t 時溫度T和壓強P與反應物B在混合氣體中的百分含量B%的關系曲線。由曲線分析,下列判斷正確的是

A. T1<T2,P1>P2,m+n>p,△H<0
B. T1>T2,P1<P2,m+n>p,△H>0
C. T1<T2,P1>P2,m+n<p,△H<0
D. T1>T2,P1<P2,m+n<p,△H>0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】白磷與氧可發生如下反應:P4+5O2=P4O10。已知斷裂下列化學鍵需要吸收的能量分別為:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根據圖示的分子結構和有關數據估算該反應的△H,其中正確的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com