
(16分)運用化學反應原理研究NH3的性質具有重要意義。請回答下列問題:
(1)已知:①4NH3(g)+3O2(g)===2N2(g)+6H2O(g) 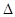 H=-1266.8kJ·mol-1
H=-1266.8kJ·mol-1
②N2(g)+O2(g)===2NO(g) 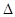 H=180.5kJ·mol-1
H=180.5kJ·mol-1
寫出氨高溫催化氧化的熱化學方程式 。
(2)氨氣、空氣可以構成燃料電池,其電池反應原理為4NH3+3O2===2N2+6H2O。則原電解質溶液顯 (填“酸性”、“中性”或“堿性”),負極的電極反應式為 。
(3)合成氨技術的創立開辟了人工固氮的重要途徑,其研究來自正確的理論指導,合成氨反應的平衡常數K值和溫度的關系如下: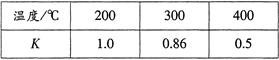
①由上表數據可知該反應為放熱反應,理由是 ;
②理論上,為了增大平衡時H2的轉化率,可采取的措施是 (填字母序號);
a.增大壓強 b.使用合適的催化劑
c.升高溫度 d.及時分離出產物中的NH3
③400oC時,測得某時刻氨氣、氮氣、氫氣的物質的量濃度分別為3mol·L-1、2mol·L-1、1mol·L-1時,此時刻該反應的v正(N2) v逆(N2)(填“>”、“<”或“=”)。
(4)①25oC時,將amol·L-1的氨水與0.1mol·L-1的鹽酸等體積混合。當溶液中c(NH4+)=c(Cl-)時,用含a的代數式表示NH3·H2O的電離常數Kb= ;
②向25mL0.10mol·L-1的鹽酸中滴加氨水至過量,該過程中離子濃度大小關系一定不正確的是 (填字母序號)。
a.c(Cl-)>c(H+)>c(NH4+)>c(OH-) b.c(C1-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(1)4NH3(g)+5O2(g)===4NO(g)+6H2O(g) 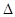 H=-905.8kJ·mol-1。
H=-905.8kJ·mol-1。
(2)堿性,2NH3+6OH-—6e-===N2+6H2O。
(3)①隨著溫度的升高,平衡常數減小;②ad ;③<。
(4)①10?8/a-0.1;②d。
解析試題分析:(1)已知:①4NH3(g)+3O2(g)===2N2(g)+6H2O(g) 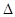 H=-1266.8kJ·mol-1,
H=-1266.8kJ·mol-1,
②N2(g)+O2(g)===2NO(g) 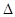 H=180.5kJ·mol-1,根據蓋斯定律:①+②×2得氨高溫催化氧化的熱化學方程式為4NH3(g)+5O2(g)===4NO(g)+6H2O(g)
H=180.5kJ·mol-1,根據蓋斯定律:①+②×2得氨高溫催化氧化的熱化學方程式為4NH3(g)+5O2(g)===4NO(g)+6H2O(g) 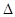 H=-905.8kJ·mol-1。(2)氨氣、空氣可以構成燃料電池,其電池反應原理為4NH3+3O2===2N2+6H2O。為減少氨氣的溶解損失,則原電解質溶液顯堿性,負極的電極反應式為2NH3+6OH-—6e-===N2+6H2O。(3)①由上表數據可知該反應為放熱反應,理由是隨著溫度的升高,平衡常數減小;②合成氨的反應正向為氣體體積減小的放熱反應,為了增大平衡時H2的轉化率,需使平衡正向移動,a.增大壓強,平衡正向移動,正確;b.使用合適的催化劑,平衡不移動,錯誤; c.升高溫度,平衡逆向移動,錯誤;d.及時分離出產物中的NH3,平衡正向移動,正確,選ad ;③利用Q與K的關系判斷。400oC時,測得某時刻氨氣、氮氣、氫氣的物質的量濃度分別為3mol·L-1、2mol·L-1、1mol·L-1時,此時刻Q=4.5,K=0.5,Q>K,反應逆向進行,v正(N2)<v逆(N2)。 (4)①根據電荷守恒有c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=1/2×0.1mol?L-1=0.05mol?L-1,故混合后溶液中c(NH3.H2O)=1/2amol?L-1-0.05mol?L-1=(0.5a-0.05)mol/L,NH3?H2O的電離常數Kb=10?7×0.05/0.5a-0.05=10?8/a-0.1;②鹽酸與氨水反應可能出現三種情況:Ⅰ、鹽酸過量,體系為NH4Cl和HCl溶液:a鹽酸過量的較多(即開始向酸液中滴加氨水)時,c(Cl-)>c(H+)>c(NH4+)>c(OH-);b鹽酸稍稍過量時:c(Cl-)>c(NH4+)>c(H+)>c(OH-);Ⅱ、兩者恰好完反應,體系為NH4Cl溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-);Ⅲ、氨水過量:體系為NH4Cl溶液和NH3.H2O:a氨水稍過量時,溶液呈中性:c (Cl-)=c(NH4+)>c(H+)=c(OH-);b氨水稍稍過量時,溶液呈中性以前:c(NH4+)>c(Cl-)>c(H+)>c(OH-);c氨水過量較多時,溶液呈堿性:c(NH4+)>c(Cl-)>c(OH-)>c(H+)或c(NH4+)>c(OH-)>c(Cl-)>c(H+),綜上所述,不可能出現c(OH-)>c(NH4+)>c(H+)>c(Cl-),選d。
H=-905.8kJ·mol-1。(2)氨氣、空氣可以構成燃料電池,其電池反應原理為4NH3+3O2===2N2+6H2O。為減少氨氣的溶解損失,則原電解質溶液顯堿性,負極的電極反應式為2NH3+6OH-—6e-===N2+6H2O。(3)①由上表數據可知該反應為放熱反應,理由是隨著溫度的升高,平衡常數減小;②合成氨的反應正向為氣體體積減小的放熱反應,為了增大平衡時H2的轉化率,需使平衡正向移動,a.增大壓強,平衡正向移動,正確;b.使用合適的催化劑,平衡不移動,錯誤; c.升高溫度,平衡逆向移動,錯誤;d.及時分離出產物中的NH3,平衡正向移動,正確,選ad ;③利用Q與K的關系判斷。400oC時,測得某時刻氨氣、氮氣、氫氣的物質的量濃度分別為3mol·L-1、2mol·L-1、1mol·L-1時,此時刻Q=4.5,K=0.5,Q>K,反應逆向進行,v正(N2)<v逆(N2)。 (4)①根據電荷守恒有c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=1/2×0.1mol?L-1=0.05mol?L-1,故混合后溶液中c(NH3.H2O)=1/2amol?L-1-0.05mol?L-1=(0.5a-0.05)mol/L,NH3?H2O的電離常數Kb=10?7×0.05/0.5a-0.05=10?8/a-0.1;②鹽酸與氨水反應可能出現三種情況:Ⅰ、鹽酸過量,體系為NH4Cl和HCl溶液:a鹽酸過量的較多(即開始向酸液中滴加氨水)時,c(Cl-)>c(H+)>c(NH4+)>c(OH-);b鹽酸稍稍過量時:c(Cl-)>c(NH4+)>c(H+)>c(OH-);Ⅱ、兩者恰好完反應,體系為NH4Cl溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-);Ⅲ、氨水過量:體系為NH4Cl溶液和NH3.H2O:a氨水稍過量時,溶液呈中性:c (Cl-)=c(NH4+)>c(H+)=c(OH-);b氨水稍稍過量時,溶液呈中性以前:c(NH4+)>c(Cl-)>c(H+)>c(OH-);c氨水過量較多時,溶液呈堿性:c(NH4+)>c(Cl-)>c(OH-)>c(H+)或c(NH4+)>c(OH-)>c(Cl-)>c(H+),綜上所述,不可能出現c(OH-)>c(NH4+)>c(H+)>c(Cl-),選d。
考點:考查蓋斯定律、焓變的計算,燃料電池,化學反應速率和化學平衡,電離常數計算及離子濃度大小比較。


科目:高中化學 來源: 題型:填空題
(12分)科學家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理為:N2(g)+3H2(g)  2NH3(g)
2NH3(g)  H="-92.4" kJ/mol,該反應的能量變化如圖所示。
H="-92.4" kJ/mol,該反應的能量變化如圖所示。
①在反應體系中加入催化劑,反應速率增大,E2的變化是 (填“增大”、“減小”或“不變”)。
②將0.3 mol N2和0.5 mol H2充入體積不變的密閉容器中,在一定條件下達到平衡,測得容器內氣體壓強變為原來的 ,此時H2的轉化率為 (計算出結果);欲提高該容器中H2的轉化率,下列措施可行的是 (填選項字母)。
,此時H2的轉化率為 (計算出結果);欲提高該容器中H2的轉化率,下列措施可行的是 (填選項字母)。
| A.向容器中按原比例再充入原料氣 | B.向容器中再充入一定量H2 |
| C.改變反應的催化劑 | D.液化生成物分離出氨 |
 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H="+1530" kJ/mol
H="+1530" kJ/mol H="+44.0" kJ/mol
H="+44.0" kJ/mol 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H = kJ/mol,該反應的化學平衡常數表達式為K= ,控制其他條件不變,增大壓強,K值 (填“增大”、“減小”或“不變”)。
H = kJ/mol,該反應的化學平衡常數表達式為K= ,控制其他條件不變,增大壓強,K值 (填“增大”、“減小”或“不變”)。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
硫酸的消費量是衡量一個國家化工生產水平的重要標志。
(1)一定條件下,SO2與空氣反應10 min后,SO2和SO3物質的量濃度分別為1.2 mol/L和2.0 mol/L,則SO2起始物質的量濃度為______;生成SO3的化學反應速率為______。
(2)若改變外界條件,發生SO2與空氣反應生成SO3,使10 min內的用O2表示的反應速率為0.15mol/(L·min),則改變的條件可能是_______________。
| A.壓縮體積,增大壓強 | B.降低溫度 | C.充入大量的氮氣 | D.僅增加SO2的濃度 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(10分,每空2分) 往一個容積為5L的密閉容器中,通入2molN2和3molH2,在一定條件下,發生反應 N2+3H2 2NH3,2 min后測得容器中生成了1mol NH3,試求:
2NH3,2 min后測得容器中生成了1mol NH3,試求:
(1)2 min時,N2的物質的量 ; (2)2 min時,H2的物質的量濃度 ;
(3)2 min時,H2的轉化率 ; (4)2min內,N2的平均反應速率 ;
(5)N2、H2、NH3的反應速率之比 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(17分)氮化硅是一種新型陶瓷材料,它可由石英晶體與焦炭顆粒在高溫的氮氣流中,通過如下反應制得:3SiO2 + 6C + 2N2 Si3N4 + 6CO,該反應過程中的能量變化如圖⑵所示;回答下列問題:
Si3N4 + 6CO,該反應過程中的能量變化如圖⑵所示;回答下列問題: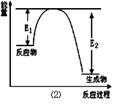
(1)上述反應中的還原劑是 ,還原產物是 。
(2)該反應是 (填“吸熱”或“放熱”)反應。
(3)在一定溫度下,上述反應在4L密閉容器內進行,用M、N兩種物質描述其物質的量隨時間變化的曲線如圖⑶所示: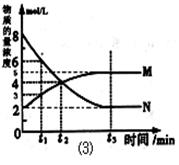
①M、N表示的物質分別為 、 。
②比較t2時刻,正逆反應速率大小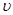 (正)
(正) 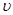 (逆)。
(逆)。
(填“>”、“=”、“<”)。.
③若t2=2min,計算反應開始至t2時刻,M的平均化學反應速率為 。
④t3時刻化學反應達到平衡時反應物的轉化率為 。
(4)①某種氫燃料電池是用固體金屬氧化物陶瓷作電解質,某電極上發生的電極反應為:A極H2-2e-+O2-===H2O;則A極是電池的 極 (填“正”或“負”)。
②上述合成氮化硅的反應產生的尾氣不能排放,經過處理以后可以用下圖所示的儀器測量尾氣中CO的含量。多孔電極中間的固體氧化鋯—氧化釔為電解質,這種固體電解質允許O2-在其間通過,其工作原理如圖⑷所示,其中多孔Pt電極a、b分別是氣體CO、O2的載體。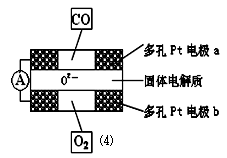
Ⅰ.該電池的正極為 (填a或b);O2 流向 (填 “正極”或“負極”)
Ⅱ.該電池的正極反應式為 ,負極反應式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
汽車尾氣中含有CO、NO2等有毒氣體,對汽車加裝尾氣凈化裝置,可使有毒氣體相互反應轉化為無毒氣體。汽車尾氣中CO與H2O(g)在一定條件下可以發生反應:
CO(g)+H2O(g) CO2(g)+H2(g)ΔH<0。820 ℃時在甲、乙、丙三個恒容密閉容器中,起始時按照下表進行投料,達到平衡狀態,K=1.0。
CO2(g)+H2(g)ΔH<0。820 ℃時在甲、乙、丙三個恒容密閉容器中,起始時按照下表進行投料,達到平衡狀態,K=1.0。
| 起始物質的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(16分)在一容積為2 L的密閉容器內加入0.2 molA和0.6 molB,在一定條件下發生反應:A(s)+3B(g) 2C(s)+3D(g) 已知該反應在不同溫度下的平衡常數如下表:
2C(s)+3D(g) 已知該反應在不同溫度下的平衡常數如下表:
| 溫度/℃ | 1000 | 1150 | 1300 |
| 平衡常數 | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
反應A(g) 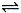 B(g) +C(g)在容積為1.0L的密閉容器中進行,A的初始濃度為0.050mol/L。溫度T1和T2下A的濃度與時間關系如圖所示。回答下列問題:
B(g) +C(g)在容積為1.0L的密閉容器中進行,A的初始濃度為0.050mol/L。溫度T1和T2下A的濃度與時間關系如圖所示。回答下列問題:
(1)上述反應的溫度T1 T2,平衡常數K(T1) K(T2)。(填“大于”、“小于”或“等于”)
(2)若溫度T2時,5min后反應達到平衡,A的轉化率為70%,則:
①平衡時體系總的物質的量為 。
②反應的平衡常數K= 。
③反應在0~5min區間的平均反應速率v(A)= 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
甲醇是重要的化學工業基礎原料和液體燃料。工業上可利用CO或CO2來生產燃料甲醇。已知甲醇制備的有關化學反應以及在不同溫度下的化學反應平衡常數如下表所示:
| 化學反應 | 平衡常數 | 溫度(℃) | |
| 500 | 800 | ||
①2H2(g)+CO(g)  CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)  H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g)  CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | | |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com