
【題目】BaCl2可用于電子、儀表等工業。以毒重石(主要成分BaCO3,含少量CaCO3、MgSO4、Fe2O3、SiO2等雜質)為原料,模擬工業提取BaCl2·2H2O的流程如下:
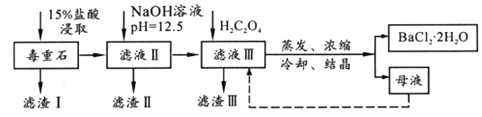
已知:(1)Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(2)離子濃度小于至1×10-5認為沉淀完全。
Ca2+ | Mg2+ | Fe3+ | |
開始沉淀時的pH | 11.9 | 9.1 | 1.9 |
完全沉淀時的pH | 13.9 | 11.0 | 3.7 |
(1)濾渣I的成分為________(填化學式),過濾所需玻璃儀器有______________。
(2)加入NaOH溶液后所得濾液III中,含有的Mg2+濃度為_____;加入H2C2O4時應避免過量,其原因是__________________________________。
(3)BaCl2母液中除了含有Ba+、Cl-外,還含有大量的______(填離子符號)。有人從“綠色化學”角度設想將“母液”沿虛線進行循環使用,請分析在實際工業生產中是否可行,_______(填“可行”或“不可行”),理由是_______________________。
(4)濾渣III是結石的主要成分,現將濾渣III 經過洗滌干燥后在有氧環境下進行熱重分析,取146.0g灼燒,所得參數如下表。
溫度(℃) | 常溫 | 190200 | 470480 |
質量(g) | 146.0 | 128.0 | 100.0 |
濾渣III 的成分是__________(填化學式);200~470℃時發生反應的化學方程式為___________。
【答案】 SiO2、BaSO4 玻璃棒、燒杯、漏斗 1.0×10-8mol/L 防止生成BaC2O4 Na+ 不可行 母液中的NaCl濃度會越來越大,最終產品純度降低 CaC2O4·H2O 2CaC2O4+O2 ![]() 2CaCO3+2CO2
2CaCO3+2CO2
【解析】毒重石(主要成分BaCO3,含少量CaCO3、MgSO4、Fe2O3、SiO2等雜質)加入鹽酸溶解,生成氯化鈣、氯化鎂、氯化鋇和氯化鐵,且少量硫酸根與鋇離子反應生成硫酸鋇,濾渣Ⅰ為SiO2、BaSO4;加入氫氧化鈉調節pH=12.5,鐵離子、鎂離子轉化為氫氧化鎂、氫氧化鐵沉淀進入濾渣Ⅱ,濾液為氯化鋇和氯化鈣,加入草酸反應生成草酸鈣沉淀,即濾渣Ⅲ為草酸鈣;濾液Ⅲ蒸發濃縮、冷卻結晶得到氯化鋇晶體。(1)濾渣I的成分為SiO2、BaSO4,過濾所需玻璃儀器有玻璃棒、燒杯、漏斗;(2)鎂離子完全沉淀的pH=11,則Ksp[Mg(OH)2] =c(Mg2+)c2(OH-)=10-5![]() (10-3)2=1.0×10-11,當pH=12.5時,c(OH-)=10-1.5mol/L,Ksp[Mg(OH)2] =c(Mg2+)c2(OH-)=c(Mg2+)
(10-3)2=1.0×10-11,當pH=12.5時,c(OH-)=10-1.5mol/L,Ksp[Mg(OH)2] =c(Mg2+)c2(OH-)=c(Mg2+)![]() (10-1.5)2=1.0×10-11,加入NaOH溶液后所得濾液III中,含有的Mg2+濃度為1.0×10-8mol/L;加入H2C2O4時應避免過量,其原因是防止生成BaC2O4 ;(3)BaCl2母液中除了含有Ba+、Cl-外,過程中加入氫氧化鈉,故還含有大量的Na+。有人從“綠色化學”角度設想將“母液”沿虛線進行循環使用,在實際工業生產中不可行,因為母液中的NaCl濃度會越來越大,最終產品純度降低;(4)根據上面分析可知,濾渣III的成分是CaC2O4·H2O;根據CaC2O4和CaCO3的相對分子質量分別為146、100,200~470℃時發生反應生成物為碳酸鈣和二氧化碳,反應的化學方程式為2CaC2O4+O2
(10-1.5)2=1.0×10-11,加入NaOH溶液后所得濾液III中,含有的Mg2+濃度為1.0×10-8mol/L;加入H2C2O4時應避免過量,其原因是防止生成BaC2O4 ;(3)BaCl2母液中除了含有Ba+、Cl-外,過程中加入氫氧化鈉,故還含有大量的Na+。有人從“綠色化學”角度設想將“母液”沿虛線進行循環使用,在實際工業生產中不可行,因為母液中的NaCl濃度會越來越大,最終產品純度降低;(4)根據上面分析可知,濾渣III的成分是CaC2O4·H2O;根據CaC2O4和CaCO3的相對分子質量分別為146、100,200~470℃時發生反應生成物為碳酸鈣和二氧化碳,反應的化學方程式為2CaC2O4+O2 ![]() 2CaCO3+2CO2。
2CaCO3+2CO2。


 導學與測試系列答案
導學與測試系列答案 新非凡教輔沖刺100分系列答案
新非凡教輔沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】研究性學習小組在辛集中學的玫瑰園與辛中公園附近分別采集一份土壤,分別配制成體積相同的兩份營養液,其中兩份各成分的含量如下:
含量 成分 | KCl | K2SO4 | ZnSO4 | ZnCl2 |
① | 0.3mol | 0.2mol | 0.1mol | ﹣ |
② | 0.1mol | 0.3mol | ﹣ | 0.1mol |
兩份營養液的成分
A. 完全不同 B. 完全相同
C. 只有n(K+)相同 D. 只有 n(Cl﹣)相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某紅色固體粉末樣品可能含有Fe2O3和Cu2O中的一種或兩種,某校化學自主探究實驗小組擬對其組成進行探究。
查閱資料:Cu2O在酸性溶液中會發生反應:Cu2O+2H+=Cu+Cu2++H2O
探究一:用如圖所示裝置進行實驗,回答下列問題:

(1)儀器組裝完成后,夾好止水夾,_____,則說明裝置A的氣密性良好.
(2)裝置A是氫氣的發生裝置,可以選用的藥品是________(填選項)
A.稀硫酸和鋅片B.稀硝酸和鐵片 C.氫氧化鈉溶液和鋁片D.濃硫酸和鎂片
(3)從下列實驗步驟中,選擇正確的操作順序:①________③(填序號).
①打開止水夾②熄滅C處的酒精噴燈 ③C處冷卻至室溫后,關閉止水夾
④點燃C處的酒精噴燈 ⑤收集氫氣并驗純⑥通入氣體一段時間,排盡裝置內的空氣
探究二:
(4)甲同學取少量樣品于試管中,加入適量的稀硫酸,若無紅色物質生成,則說明樣品中不含Cu2O;乙同學認為觀點不正確,其原因是_____________;丙同學另取少量樣品于試管中,加入適量的濃硝酸,產生紅棕色的氣體.證明樣品中一定含有________,其反應的離子方程式為_____;丁同學預設計實驗證明另一種物質是否存在,其方案為__________。
(5)取一定量樣品于燒杯中,加入足量的稀硫酸,若反應后經過濾得到固體3.2g,濾液中Fe2+有1.0mol,則樣品中n(Cu2O)=_________mol.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaNO2是一種食品添加劑,具有致癌性。酸性KMnO4溶液與NaNO2反應的化學方程式為:MnO4+NO2+□→ Mn2++NO3+H2O(未配平)。下列敘述中正確的是
A. 該反應中NO2被還原 B. 生成1 mol NaNO3需消耗0.4 mol KMnO4
C. 反應過程中溶液的酸性增強 D. □中的粒子是OH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A. 乙醇和汽油(從石油中提煉)都是可再生能源,應大力推廣“乙醇汽油”
B. 推廣使用太陽能、風能、海洋能、氫能,有利于緩解溫室效應
C. 氫能具有的優點是原料來源廣、熱值高、儲存方便、制備工藝廉價易行
D. 氫能是一次能源(從自然界中以現成形式提供的能源為一次能源)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知反應:K2Cr2O7 + 14HCl=2KCl + 2CrCl3 + 3Cl2↑+ 7H2O,用“單線橋”表示電子轉移的方向和數目,并指出氧化產物和還原產物_____________ 。
(2)Cl2是一種有毒氣體,如果泄漏會造成嚴重的環境污染。化工廠可用濃氨水來檢驗Cl2是否泄漏,有關反應的化學方程式為:3Cl2(氣)+8NH3(氣)=6NH4Cl(固)+N2(氣),若反應中消耗Cl2 1.5 mol,求被氧化的NH3在標準狀況下的體積_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于sp3雜化軌道說法正確的是( )
A. 凡是中心原子采取sp3雜化方式成鍵的分子其幾何構型都是四面體
B. ![]() 分子中的
分子中的![]() 雜化軌道是由4個H原子的1s軌道和C原子的2p軌道混合起來而形成的
雜化軌道是由4個H原子的1s軌道和C原子的2p軌道混合起來而形成的
C. 金剛石是三維網狀結構,由碳原子從sp3雜化軌道形成共價鍵
D. NH3和BF3分子中,中心原子均采用sp3雜化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含氟的鹵素互化物通常作氟化劑,使金屬氧化物轉化為氟化物,如2Co3O4+6C1F3= 6CoF3+3C12+4X。下列有關該反應的說法,正確的是
A. X與O3互為同位素 B. ClF3中氯元素為-3價
C. Co3O4在反應中作氧化劑 D. lmol Co3O4參加反應轉移9 mol電子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com