
【題目】鋼鐵分析中常用過硫酸鹽氧化法測定鋼中錳的含量,反應原理為:2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基態Mn原子的價電子排布式為___________。
(2)現代化學中,常利用_______________________上的特征譜線來鑒定元素。
(3)已知H2S2O8的結構如圖。H2S2O8硫原子的軌道雜化方式為__________;上述反應每生成1molMnO4-,S2O82-斷裂的共價鍵類型及其數目為_____________________;與硫酸根等電子體的分子或離子有______________________(寫兩種)。

(4)一定條件下,水分子間可通過氫鍵將從H2O分子結合成三維骨架結構,其中的多面體孔穴中可包容氣體小分子,形成籠形水合包合物晶體。如圖是一種由水分子構成的正十二面體骨架(“o”表示水分子),其包含的氫鍵數為___________;實驗測得冰中氫鍵的作用能為18.8kJ·mol-1,而冰的熔化熱為5.0kJ·mol-1,其原因可能是_________________。

(5)與Mn同周期相鄰的元素X,價電子層有2對成對電子,其離子型氧化物晶胞如圖所示。它由A、B方塊組成。則該氧化物中X2+、X3+、O2-的個數比為_____________(填最簡整數比);已知該晶體的密度為d g/cm3,阿伏伽德羅常數的值為NA,則晶胞參數a為_________nm (用含d和NA的代數式表示)

【答案】 3d54s2 原子光譜 sp3 非極性鍵 2.5NA CCl4、SiF4或其他合理答案 30 液態水中仍然存在大量氫鍵 1∶2∶4 ![]() ×107
×107
【解析】(1)錳原子序數為25,質子數為25,原子核外電子數為25,根據能量最低原則,錳的電子排布式為:[Ar]3d54s2,價電子排布式為:3d54s2;故答案為:3d54s2;
(2)現代化學中,常利用上原子光譜的特征譜線來鑒定元素,故答案為:原子光譜;
(3)H2S2O8中,硫原子價層電子對數=σ 鍵電子對+中心原子上的孤電子對=4+![]() (6-4×1-2)=4,所以采取sp3雜化;由反應可知,Mn元素的化合價升高(+2→+7),S元素的化合價降低(+7→+6),生成10molSO42-轉移電子10mol電子,則每生成1molMnO4-,轉移電子5mol電子,S2O82-斷裂2.5mol(或2.5NA)O-O間非極性共價鍵;與硫酸根等電子體的分子或離子有CCl4、SiF4、ClO4-等,故答案為:sp3雜化;非極性鍵;2.5NA;CCl4、SiF4、ClO4-等;
(6-4×1-2)=4,所以采取sp3雜化;由反應可知,Mn元素的化合價升高(+2→+7),S元素的化合價降低(+7→+6),生成10molSO42-轉移電子10mol電子,則每生成1molMnO4-,轉移電子5mol電子,S2O82-斷裂2.5mol(或2.5NA)O-O間非極性共價鍵;與硫酸根等電子體的分子或離子有CCl4、SiF4、ClO4-等,故答案為:sp3雜化;非極性鍵;2.5NA;CCl4、SiF4、ClO4-等;
(4)由此結構可知,此單元中含有水分子的個數為:20,其中每個水分子形成的氫鍵屬于2個五元環,故每個水分子形成氫鍵個數為![]() ,故總共形成氫鍵數為:20×
,故總共形成氫鍵數為:20×![]() =30;冰中氫鍵的作用能為18.8kJmol-1,而冰熔化熱為5.0kJmol-1,說明冰熔化為液態水時只是破壞了一部分氫鍵,并且液態水中仍在氫鍵;故答案為:30;液態水中仍然存在大量氫鍵;
=30;冰中氫鍵的作用能為18.8kJmol-1,而冰熔化熱為5.0kJmol-1,說明冰熔化為液態水時只是破壞了一部分氫鍵,并且液態水中仍在氫鍵;故答案為:30;液態水中仍然存在大量氫鍵;
(5)與Mn同周期相鄰的元素X,價電子層有2對成對電子,價電子層排布式為3d6s2,X為鐵元素,由A、B方塊的結構可知,A中含有O2-的數目為4,含有Fe2+的數目為4×![]() +1=
+1=![]() ,B中含有O2-的數目為4,含有Fe2+的數目為4×
,B中含有O2-的數目為4,含有Fe2+的數目為4×![]() =
=![]() ,Fe3+的數目為4,則晶胞中含有O2-的數目為(4+4)×4=32,Fe2+的數目為(
,Fe3+的數目為4,則晶胞中含有O2-的數目為(4+4)×4=32,Fe2+的數目為(![]() +
+![]() )×4=8,Fe3+的數目為4×4=16,Fe 2+、Fe 3+、O2-的個數比為8:16:32=1:2:4;該晶體的化學式為Fe3O4,則該晶體的密度為d g/cm3=
)×4=8,Fe3+的數目為4×4=16,Fe 2+、Fe 3+、O2-的個數比為8:16:32=1:2:4;該晶體的化學式為Fe3O4,則該晶體的密度為d g/cm3=![]() g/cm3,解得a=
g/cm3,解得a=![]() cm=
cm=![]() ×107nm,故答案為:1∶2∶4;
×107nm,故答案為:1∶2∶4;![]() ×107。
×107。


科目:高中化學 來源: 題型:
【題目】在恒溫、恒容密閉容器中發生反應: A(s) +2B(g)![]() C(g)+D(g),當下列物理量不再發生變化時,表明該反應已達到平衡狀態的是
C(g)+D(g),當下列物理量不再發生變化時,表明該反應已達到平衡狀態的是
①混合氣體的壓強 ②混合氣體的密度 ③各氣態物質的物質的量濃度
④氣體的總物質的量 ⑤混合氣體的平均相對分子質量
A. ②③⑤ B. ①②③ C. ②③④⑤ D. ①③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,向容積可變的密閉容器中通入N2和H2,發生反應:N2(g)+3H2(g) ![]() 2NH3(g)ΔH<0達到平衡后,試回答下列問題:
2NH3(g)ΔH<0達到平衡后,試回答下列問題:
(1)該條件下,反應的平衡常數表達式K=______;若降低溫度,K值將______(填“增大”、“減小”或“不變”)。
(2)達到平衡后,若其它條件不變,把容器體積縮小一半,平衡將____(填“向逆反應方向”、“向正反應方向”或“不”)移動,平衡常數K將_____ (填“增大”、“減小”或“不變”)。
(3)達到平衡后,在恒壓條件下,向容器中通人氦氣(He),氮氣的轉化率將___(填“增大”、“減小”或“不變”)。
(4)在三個相同的容器中各充入1molN2和3molH2,在不同條件下分別達到平衡,氨的體積分數ω隨時間變化如圖所示。下列說法正確的是_______ (填序號)。
a.圖I可能是不同壓強對反應的影響,且P2>P1
b.圖Ⅱ可能是同溫同壓下催化劑對反應的影響,且催化性能1>2
c.圖Ⅱ可能是不同溫度對反應的影響,且T1>T2
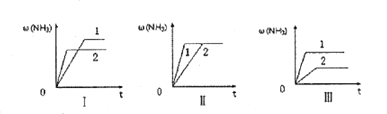
(5)A、B兩個容積相同的容器中各充入1molN2和3molH2,A容器保持恒溫恒容達到平衡時氫氣的物質的量為x,B容器保持恒溫恒壓達到平衡時氫氣的物質的量為y,則x____y(“>”“<”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組離子在相應的條件下可能大量共存的是
A. 能使pH試紙變紅的溶液中:CO32-、K+、Cl-、Na+
B. 由水電離產生的c(OH-)=1×10-10 mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C. 在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3-
D. ![]() =10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
=10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)明礬可用于凈水,原因是(用離子方程式表示):_______________________。把FeCl3溶液蒸干,灼燒,最后得到的主要固體產物是________________________。
(2)用離子方程式表示泡沫滅火器滅火原理:_______________________________。
(3)純堿可代替洗滌劑洗滌餐具,原因是(用離子方程式表示):________________。
(4)為了除去MgCl2酸性溶液中的Fe3+,可在加熱攪拌的條件下加入MgCO3固體,過濾后再加入足量鹽酸。MgCO3固體能除去Fe3+的原因是____________________。
(5)如圖是SO2生成SO3反應過程中能量變化的曲線圖。該反應的熱化學方程式為____________________________________________________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】相同溫度下,根據三種酸的電離常數,下列判斷正確的是( )

A. 三種酸的強弱關系:HX>HY>HZ
B. 反應HZ+Y-===HY+Z-能夠發生
C. 相同溫度下,0.1 mol/L的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D. 相同溫度下,1 mol/L HX溶液的電離常數大于0.1 mol/L HX
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com