
【題目】下列說法正確的是( )
A.常溫下,反應4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自發進行,則△H<0
B.鐵片鍍鋅時,鐵片與外電源的正極相連
C.以熔融NaCl為電解質進行電解冶煉鈉,熔融體中Na+向陽極移動
D.t℃時,恒容密閉容器中反應:NO2(g)+SO2(g)![]() NO(g)+SO3(g),通入少量O2,
NO(g)+SO3(g),通入少量O2,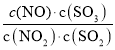 的值及SO2轉化率不變
的值及SO2轉化率不變
 導學全程練創優訓練系列答案
導學全程練創優訓練系列答案科目:高中化學 來源: 題型:
【題目】一定溫度下,濃度均為1mol·L-1的A2和B2兩種氣體,在密閉容器內反應生成氣體C,反應達平衡后,測得:c(A2)=0.58 mol·L-1,c(B2)=0.16 mol·L-1,c(C)=0.84 mol·L-1,則該反應的正確表達式為( )
A.2A2+B2![]() 2A2BB.A2+B2
2A2BB.A2+B2![]() 2ABC.A2+B2
2ABC.A2+B2![]() A2B2D.A2+2B2
A2B2D.A2+2B2![]() 2AB2
2AB2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硒(Se)是第四周期ⅥA族元素,是人體內不可或缺的微量元素,其氫化物H2Se是制備新型光伏太陽能電池、半導體材料和金屬硒化物的基礎原料。
(1)已知:①2H2Se(g)+O2(g)![]() 2Se(s)+2H2O(l) ΔH1=a kJ·mol1
2Se(s)+2H2O(l) ΔH1=a kJ·mol1
②2H2(g)+O2(g)= 2H2O(l) ΔH2=b kJ·mol1
反應H2(g)+Se(s)![]() H2Se(g)的反應熱ΔH3=___________kJ·mol1(用含a、b的代數式表示)。
H2Se(g)的反應熱ΔH3=___________kJ·mol1(用含a、b的代數式表示)。
(2)T℃時,向一恒容密閉容器中加入3molH2和lmolSe,發生反應H2(g)+Se(s)![]() H2Se(g)。
H2Se(g)。
①下列情況可判斷反應達到平衡狀態的是___________(填字母)。
a.氣體的密度不變 b.υ(H2)=υ(H2Se)
c.氣體的壓強不變 d.氣體的平均摩爾質量不變
②當反應達到平衡后,將平衡混合氣體通入氣體液化分離器使H2Se氣體轉化為液體H2Se,并將分離出的H2再次通入發生反應的密閉容器中繼續與Se反應時,Se的轉化率會提高。請用化學平衡理論解釋_________________________________。
③以5小時內得到的H2Se為產量指標,且溫度、壓強對H2Se產率的影響如下圖所示:
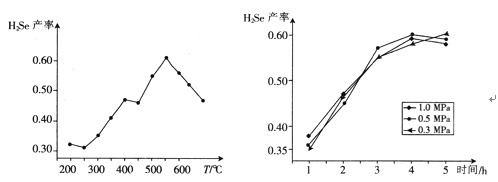
則制備H2Se的最佳溫度和壓強為______________________。
(3)已知常溫下H2Se的電離平衡常數K1=1.3×104,K2=5.0×1011,則NaHSe溶液呈___________(填“酸性”或“堿性”),該溶液中的物料守恒關系式為____________________。
(4)用電化學方法制備H2Se的實驗裝置如下圖所示:
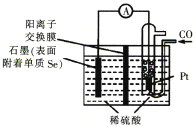
寫出Pt電極上發生反應的電極反應式:_________________________________。
(5)H2Se在一定條件下可以制備CuSe,已知常溫時CuSe的Ksp=7.9×1049,CuS的Ksp=1.3×1036,則反應CuS(s)+Se2-(aq)![]() CuSe(s)+S2-(aq)的化學平衡常數K=________(保留2位有效數字)。
CuSe(s)+S2-(aq)的化學平衡常數K=________(保留2位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(物質結構與性質)
硅電池、鋰離子電池都是現代高性能電池的代表,高性能的電極材料與物質結構密切相關。
(l) LiFePO4因具有良好的結構穩定性而成為新一代正極材料,這與PO43-的結構密切相關,PO43-的立體構型為____。P、O、S的電負性從大到小的順序為______________
(2)通常在電極材料表面進行“碳”包覆處理以增強其導電性。抗壞血酸 常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗壞血酸中碳原子的雜化方式為 ___,1mol抗壞血酸中手性碳原子的數目為______。(取材于選修3課本51頁)。
常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗壞血酸中碳原子的雜化方式為 ___,1mol抗壞血酸中手性碳原子的數目為______。(取材于選修3課本51頁)。
(3) Li+過度脫出易導致鋰電池結構坍塌產生O2而爆炸,實驗證實O2因具有單電子而成為順磁性分子,下列結構式(黑點代表電子)中最有可能代表O2分子結構的是____(填標號)。
A.![]() B.
B. C.
C.![]() D.
D.
(4)目前最常用的電極材料有鋰鈷復合氧化物和石墨。
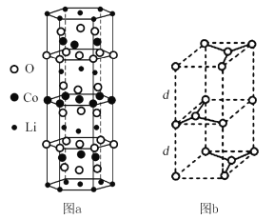
①鋰鈷復合氧化物中Li、Co、O分別形成了六邊層狀結構(圖a),按照Li-O-Co-O-Li–O-Co-O- Li--順序排列,則該化合物的化學式為____,Co3+的價層電子排布式為_____。
②石墨晶胞(圖b)層間距為d pm,C—C鍵長為a pm,石墨晶體的密度為p g/cm3,列式表示阿伏加德羅常數為____mol-l。
(5)硅酸鹽中Si元素一般顯+4價,如下圖所示是一種無限長單鍵的多聚硅酸根離子的結構,其中“![]() ”表示Si原子,“
”表示Si原子,“![]() ”表示氧原子,則該長鏈硅酸根離子的通式為________________________。
”表示氧原子,則該長鏈硅酸根離子的通式為________________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向Na2CO3溶液中滴加鹽酸,反應過程中能量變化如下圖所示,下列說法正確的是( )
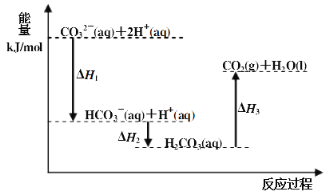
A.反應HCO3-(aq)+H+(aq)=CO2(g)+H2O(l) 為放熱反應
B.CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) H=(H1+H2+H3)
C.H1>H2 H2<H3
D.H2CO3(aq)=CO2(g)+H2O(l),若使用催化劑,則H3變小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用石墨電極完成下列電解實驗。
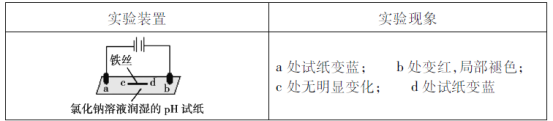
下列對實驗現象的解釋或推測不合理的是
A.a為電解池的陰極
B.b處有氯氣生成,且與水反應生成了鹽酸和次氯酸
C.c處發生了反應:Fe-3e-=Fe3+
D.d處:2H2O+2e-=H2↑+2OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物K是某藥物的合成中間體,其合成路線如圖所示:

已知:①HBr與不對稱烯桂加成時,在過氧化物作用下,則鹵原子連接到含氫較多的雙鍵碳上;
②R—CN![]() R-CH2NH2(R表示坯基);
R-CH2NH2(R表示坯基);
③R1—CN2+R-COOC2H5![]()
![]() +C2H5OH(R表示烴基或氫原子)。
+C2H5OH(R表示烴基或氫原子)。
請回答下列問題:
(1)C的化學名稱為_______________。
(2)D→E的反應類型為_________,F中官能團的名稱是____________。
(3)G→H的化學方程式為____________________。
(4)J的分子式為__________________。手性碳原子是指與四個各不相同原子或基團相連的碳原子,則K分子中的手性碳原子數目為_______。
(5)L是F的同分異構體,則滿足下列條件的L的結構簡式為____________。(任寫一種結構即可)
①lmolL與足量的NaHCO3溶液反應能生成2molCO2;
②L的核磁共振氫譜有3組峰且峰面積之比為1:2:3。
(6)請寫出J經三步反應合成K的合成路線:____________________(無機試劑任選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知100℃時,0.01mol·L-1NaHSO4溶液中水電離的c(H+)=10-10mol·L-1,該溫度下將pH=8的Ba(OH)2溶液V1L與pH=5的NaHSO4溶液V2L混合,所得溶液pH=7,則V1:V2為( )
A.2:9B.9:2C.1:9D.1:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,向0.10mol·L-1的H2C2O4(二元弱酸)溶液中滴加NaOH溶液,溶液中部分微粒的物質的量濃度隨pH的變化曲線如圖所示。下列說法不正確的是

A. 25℃時H2C2O4的一級電離常數為Ka1=104.3
B. pH=2.7的溶液中:c(H2C2O4)=c(C2O42-)
C. pH=7的溶液中:c(Na+)>2c(C2O42-)
D. 滴加NaOH溶液的過程中始終存在:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com