
在氣體反應中,能使反應物中活化分子數和活化分子百分數同時增大的方法是( )
①增大反應物的濃度 ②升高溫度 ③增大壓強 ④移去生成物 ⑤加入催化劑
| A.①③⑤ | B.②⑤ | C.②③⑤ | D.①③④ |
 能考試期末沖刺卷系列答案
能考試期末沖刺卷系列答案科目:高中化學 來源: 題型:單選題
在容積為2 L的3個密閉容器中發生反應3A(g)+B(g) xC(g),按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時有關數據如下:
xC(g),按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時有關數據如下:
| 容器 | 甲 | 乙 | 丙 |
| 反應物投入量 | 3 mol A、2 mol B | 6 mol A、4 mol B | 2 mol C |
| 到達平衡的時間(min) | 5 | | 8 |
| A的濃度(mol/L) | c1 | c2 | |
| C的體積分數 | w1 | | w3 |
| 混合氣體密度(g/L) | ρ1 | ρ2 | |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列措施不能增大反應速率的是
| A.鋅與稀硫酸反應時,加少量銅粉 |
| B.Fe與稀硫酸反應制取H2時,改用98%濃硫酸 |
| C.Al在氧氣中燃燒生成A12O3,將鋁片改成鋁粉 |
| D.恒溫時,增大H2(g)+Br2(g) ?2HBr(g)反應體系的壓強 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在一定溫度下,在恒容的密閉容器中進行的可逆反應A(g)+3B(g) 2C(g)達到平衡的標志是( )
2C(g)達到平衡的標志是( )
| A.C生成的速率和C分解的速率相等 |
| B.單位時間內生成n mol A,同時生成3n mol B |
| C.B的消耗速率與C的消耗速率之比為1∶1 |
| D.混合氣體密度保持不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
某溫度時,濃度都是1 mol·L-1的兩種氣體X2和Y2,在密閉容器中發生可逆反應生成氣體Z,充分反應后X2的濃度為0.4 mol·L-1,Y2的濃度為0.8 mol·L-1,生成的Z的濃度為0.4 mol·L-1,則該反應的化學方程式(Z用X、Y表示)是( )
A.X2+2Y2 2XY2 2XY2 | B.2X2+Y2 2X2Y 2X2Y |
C.X2+3Y2 2XY3 2XY3 | D.3X2+Y2 2X3Y 2X3Y |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
相同溫度下,體積均為0.25 L的兩個恒容密閉容器中發生可逆反應:
X2(g)+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1
2XY3(g) ΔH=-92.6 kJ·mol-1
實驗測得反應在起始、達到平衡時的有關數據如下表所示:
| 容器 編號 | 起始時各物質的物質的量/mol | 達到平衡時體系能量的變化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放熱:23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在一定溫度下,將等量的氣體分別通入起始體積相同的密閉容器Ⅰ(恒容)和Ⅱ(恒壓)中,使其發生反應,t0時容器Ⅰ中達到化學平衡,X、Y、Z的物質的量與時間的變化關系如圖所示,則下列有關推斷正確的是( )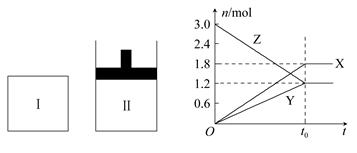
A.該反應的化學方程式:3X+2Y 3Z 3Z |
| B.若兩容器中均達到平衡后,兩容器的體積V(Ⅰ)<V(Ⅱ),則容器Ⅱ達到平衡所用時間小于t0 |
| C.若兩容器中均達到平衡后,兩容器中Z的物質的量分數相同,則Y為固態或液態 |
| D.達平衡后,若對容器Ⅱ升高溫度時其體積增大,說明Z發生的反應為吸熱反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com