
【題目】下列關于溶液中離子的說法不正確的是( )
A.0.1mol?L﹣1的Na2CO3溶液中粒子濃度關系:c(Na+)═2c(CO ![]() )+2c(HCO
)+2c(HCO ![]() )+2c(H2CO3)
)+2c(H2CO3)
B.常溫下,氫氧化鈉溶液中滴入醋酸使溶液的pH=7,則混合溶液中醋酸已過量
C.0.2mol?L﹣1的HCl和0.1 mol?L﹣1的NH3?H2O等體積混合后溶液中的離子濃度關系:c(Cl﹣)>c (NH ![]() )>c(H+)>c (OH﹣)
)>c(H+)>c (OH﹣)
D.0.1mol?L﹣1的NaHS溶液中離子濃度關系:c(S2﹣)+c(OH﹣)═c(H+)+c(H2S)
【答案】C
【解析】解:A、0.1molL﹣1的Na2CO3溶液中物料守恒式為c(Na+)=2c(CO ![]() )+2c(HCO
)+2c(HCO ![]() )+2c(H2CO3),故A正確, B、醋酸和氫氧化鈉恰好反應生成醋酸鈉溶液呈堿性,若溶液呈中性需要醋酸過量,才可以使溶液顯示中性,故B正確;
)+2c(H2CO3),故A正確, B、醋酸和氫氧化鈉恰好反應生成醋酸鈉溶液呈堿性,若溶液呈中性需要醋酸過量,才可以使溶液顯示中性,故B正確;
C、0.2molL﹣1的HCl和0.1 molL﹣1的NH3H2O等體積混合后溶液中是HCl和NH4Cl的混合溶液,溶液中銨根離子水解,氫離子濃度大于銨根離子濃度,c(Cl﹣)>c(H+)>c (NH ![]() )>c (OH﹣),故C錯誤;
)>c (OH﹣),故C錯誤;
D、0.1molL﹣1的NaHS溶液中電荷守恒,c(Na+)+c(H+)=c(OH﹣)+c(HS﹣)+2c(S2﹣),物料守恒c(Na+)=c(HS﹣)+c(S2﹣)+c(H2S),帶入計算得到c(S2﹣)+c(OH﹣)═c(H+)+c(H2S),故D正確;
故選C.


 芝麻開花課程新體驗系列答案
芝麻開花課程新體驗系列答案科目:高中化學 來源: 題型:
【題目】無色水溶液中能大量共存的一組離子是( )
A. NH4+、Ba2+、Br﹣、CO32﹣ B. Cl﹣、SO42﹣、Mg2+、H+
C. K+、Na+、SO42﹣、MnO4﹣ D. Na+、H+、NO3﹣、HCO3﹣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】配制一定物質的量濃度的溶液時,由于操作不慎,使液面略超過了容量瓶的刻度(標線),這時應采取的措施是
A.傾出標線以上的液體 B.吸出標線以上的溶液
C. 影響不大,不再處理 D.重新配制.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸亞鐵晶體(FeSO4·7H2O)在醫藥上作補血劑。某課外小組測定該補血劑中鐵元素的含量。實驗步驟如下:
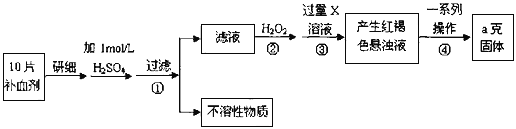
請回答下列問題:
(1)步驟①濾液中滴加KSCN溶液后濾液變為紅色,則該溶液中含有__________________(填離子符號),檢驗濾液中還存在Fe2+的方法為_________________________________________。(注明試劑、現象)
(2)步驟②加入過量H2O2的目的:____________________________________________。
(3)步驟③中反應的離子方程式:_____________________________________________。
(4)若實驗無損耗,則每片補血劑含鐵元素的質量__________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年以來,我國多地頻現種種極端天氣,二氧化碳、氮氧化物、二氧化硫是導致極端天氣的重要因素.
(1)活性炭可用于處理大氣污染物NO,在1L恒容密閉容器中加入0.100mol NO和2.030mol固體活性炭(無雜質),生成氣體E和氣體F.當溫度分別在T1℃和T2℃時,測得平衡時各物質的物質的量如下表:
①請結合上表數據,寫出NO與活性炭反應的化學方程式 .
②上述反應的平衡常數表達式K= , 根據上述信息判斷,T1和T2的關系是 .
A.T1>T2 B.T1<T2 C.無法比較
③在T1℃下反應達到平衡后,下列措施能改變NO的轉化率的是 .
a.增大c(NO) b.增大壓強 c.升高溫度 d.移去部分F
(2)碘循環工藝不僅能吸收SO2降低環境污染,同時又能制得H2 , 具體流程如圖1所示:
①用離子方程式表示反應器中發生的反應: .
②用化學平衡移動的原理分析,在HI分解反應中使用膜反應器分離出H2的目的是 .
(3)開發新能源是解決大氣污染的有效途徑之一.直接甲醇燃料電池(簡稱DMFC)由于結構簡單、能量轉化率高、對環境無污染,可作為常規能源的替代品而越來越受到關注.DMFC工作原理如圖2所示.
通過a氣體的電極是原電池的極(填“正”或“負”),b電極反應式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】治療缺鐵性貧血的常見方法是服用補鐵藥物,常采用更易被吸收的亞鐵鹽。“速力菲”(主要成分:琥珀酸亞鐵,呈暗黃色)是市場上一種常見的補鐵藥物。該藥品不溶于水,但能溶于人體中的胃酸。某同學為了檢測“速力菲”藥片中二價鐵元素,設計并實施了如下實驗:
![]()
試回答下列問題:
(1)試劑1是______________,試劑2是__________________。
(2)該同學預測加入試劑2后,溶液應依然為淺綠色,但這與實際現象不符,請用離子方程式解釋實際現象的合理性:_________________,_______________。
(3)用離子反應方程式解釋加入新制氯水后溶液變血紅色的原因:______________________________________________。
(4)補鐵藥物的說明書中通常會有“與VC同服可增加本品吸收”的內容,向淡紅色溶液中加入VC,片刻后溶液紅色褪去,試從氧化還原角度解釋補鐵藥物與VC同服的優點:___________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,現有A、B、C、D、E、F六種常見化合物,已知它們的陽離子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+ , 陰離子有Cl﹣、OH﹣、CH3COO﹣、NO3﹣、SO42﹣、CO32﹣ , 現將它們分別配成0.1mol/L的溶液,進行如下實驗:(已知:室溫下,飽和氫氧化鈣溶液濃度約為0.00165 g/mL)
①測得溶液A、C、E呈堿性,且堿性為A>E>C;
②向B溶液中滴加Na2S溶液,出現難溶于強酸且陰陽離子個數比為1:2的黑色沉淀;
③向D溶液中滴加Ba(NO3)2溶液,無明顯現象;
④向F溶液中滴加氨水,生成白色絮狀沉淀,沉淀迅速變成灰綠色,最后變成紅褐色.
根據上述實驗現象,回答下列問題:
(1)寫出下列化合物的化學式:A、B、C .
(2)實驗④中白色沉淀變為紅褐色對應的化學方程式:
(3)D與E的溶液反應離子方程式是: .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com