
化學平衡常數(K)、弱酸的電離平衡常數(Ka)、難溶物的溶度積常數(Ksp)是判斷物質性質或變化的重要的平衡常數。下列關于這些常數的說法中,正確的是( )
| A.平衡常數的大小與溫度、濃度、壓強、催化劑等有關 |
| B.當溫度升高時,弱酸的電離平衡常數Ka變小 |
| C.Ksp(AgCl)>Ksp(AgI),由此可以判斷AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能夠發生 |
| D.Ka(HCN)<Ka(CH3COOH),說明物質的量濃度相同時,氫氰酸的酸性比醋酸強 |
科目:高中化學 來源: 題型:單選題
為了同時對農作物施用含有N、P、K三種元素的化肥,對于給定的化肥:①KCl②K2CO3 ③Ca(H2PO4)2④NH4Cl⑤CO(NH2)2,不適合的組合是
| A.②③④ | B.①③④ | C.①③⑤ | D.①③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下表是相同溫度下三種酸的一些數據,下列判斷正確的是
A.在相同溫度下, > > > > |
B.室溫時,若在NaZ溶液中加水,則 / / · · 的比值變小,若加少量鹽酸,則比值變大 的比值變小,若加少量鹽酸,則比值變大 |
C.等物質的量濃度的NaX、NaY和NaZ的混合溶液,則 < < < < |
D.在相同溫度,從HX的數據可以說明:弱電解質溶液濃度越低,電離度越大,且 > > > > =0.01 =0.01 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列敘述正確的是
A.兩種難溶物質比較,溶度積小的溶解度不一定小
B.水的離子積常數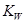 隨著溫度的升高而增大,說明水的電離是放熱反應
隨著溫度的升高而增大,說明水的電離是放熱反應
C.向0.1mol/L的氨水中加入少量硫硫酸固體,則溶液中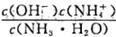 增大
增大
D:0.1mol/L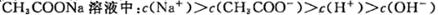
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下表是三種難溶金屬硫化物的溶度積常數(25 ℃)。
| 化學式 | FeS | CuS | MnS |
| 溶度積 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
 CuS↓+H2SO4不能發生
CuS↓+H2SO4不能發生查看答案和解析>>
科目:高中化學 來源: 題型:單選題
常溫下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 HCl溶液,滴定曲線如圖所示。下列說法不正確的是 ( )。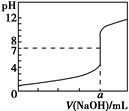
| A.若將鹽酸換成同濃度的醋酸溶液,則滴定到pH=7時,a>20.00 |
| B.該滴定也可以用甲基橙作指示劑 |
| C.若用酚酞作指示劑,當滴定到溶液由無色變為紅色且半分鐘內不褪色時停止滴定 |
| D.滴定過程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
鹽MN溶于水的過程如圖所示: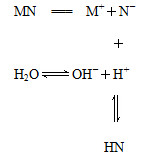
下列說法不正確的是( )
| A.MN是強電解質 |
| B.N-結合H+的能力一定比OH-強 |
| C.該過程中c(OH-)>c(H+) |
| D.溶液中存在c(HN)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
常溫下,取pH=2的兩種二元酸H2A與H2B各1 mL,分別加水稀釋,測得pH變化與加水稀釋倍數有如圖所示變化,則下列有關敘述正確的是( )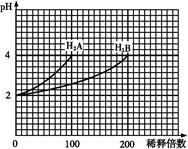
A.H2A為二元弱酸
B.PH=4的NaHA水溶液中離子濃度大小為c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合溶液中,離子濃度大小為c(Na+)=c(A2-)+c(HB-)+c(B2-)
D.Na2B的水溶液中,離子濃度大小為c(Na+)>c(B2-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com