
在2 L密閉容器中發生反應4A(s)+3B(g)=2C(g)+D(g),經2 min,B的物質的量減少0.6 mol,下列對該反應速率表示正確的是
A.在2 min末的反應速率:v (B)=0.3 mol·L-1·min-1
B.用A表示的反應速率為:v (A)=0.4 mol·L-1·min-1
C.用D表示的平均反應速率為:v (D)= 0.05 mol·L-1·min-1
D.分別用B、C表示的反應速率其比值為2∶3
C
解析試題分析:A、2min,B的物質的量減少0.6mol,則減少的B的物質的量濃度=0.6mol÷2L=0.3mol/L,所以用B物質表示的反應速率v(B)=0.3mol/L÷2min=0.15mol?L-1?min-1,A不正確;B、由于A物質為純固體,則不能利用純固體表示反應速率,故B錯誤;C、因為反應速率之比等于化學計量數之比,所以根據反應方程式可知用D表示的平均反應速率為v(D)=0.15mol?L-1?min-1×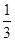 =0.05 mol?L-1?min-1,故C正確;D.反應速率之比等于化學計量數之比,則分別用B、C表示的反應速率其比值為3:2,所以D錯誤,答案選C。
=0.05 mol?L-1?min-1,故C正確;D.反應速率之比等于化學計量數之比,則分別用B、C表示的反應速率其比值為3:2,所以D錯誤,答案選C。
考點:考查反應速率的計算


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:單選題
在一定溫度下,可逆反應:A2(氣)+B2(氣) 2AB(氣),達到平衡的標志是
2AB(氣),達到平衡的標志是
| A.容器的總壓強不隨時間而變化 |
| B.單位時間內有n molA2生成的同時有n molB2生成 |
| C.單位時間內有n molB2發生反應的同時有n molAB分解 |
| D.單位時間內生成n molA2同時就有2n molAB生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
一定溫度下,將足量固體A加入恒容真空容器中發生可逆反應:2A(s) 2B(g)+C (g),下列能說明反應已達平衡狀態的是
2B(g)+C (g),下列能說明反應已達平衡狀態的是
A.混合氣體的密度保持不變 B.容器內B、C的濃度之比為2∶1
C.B的生成速率等于C的消耗速率 D.氣體的體積分數保持不變
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列說法正確的是
| A.放熱反應在常溫下一定很容易發生 |
| B.決定化學反應速率的主要因素是反應物的濃度、壓強、溫度、催化劑等 |
| C.熵增加且放熱的反應一定是自發反應 |
| D.非自發的反應即不可能進行的反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已建立化學平衡的某可逆反應X(g)+2Y(g)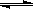 2Z(g),當條件改變使化學平衡向正反應方向移動時,下列敘述正確的是
2Z(g),當條件改變使化學平衡向正反應方向移動時,下列敘述正確的是
①生成物的質量分數一定增加,②生成物總量一定增加, ③反應物的轉化率一定增大,
④反應物的濃度一定降低,⑤正反應速率一定大于逆反應速率,⑥一定使用催化劑
| A.①②③ | B.③④⑤ | C.②⑤ | D.④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列說法正確的是
| A.增大體系壓強,活化分子數增加,化學反應速率一定增大 |
| B.加入反應物,使活化分子百分數增加,化學反應速率增大 |
| C.活化分子間所發生的分子間的碰撞均為有效碰撞 |
| D.升高溫度,活化分子百分數增加,化學反應速率一定增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
化學平衡常數(K)是化學反應限度的一個重要參數,該常數表示的意義是可逆反應進行的程度,K值越大,表示的意義錯誤的是( )
| A.溫度越高 | B.反應物濃度越小 |
| C.反應進行的越完全 | D.生成物濃度越大 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知反應:2SO2(g)+O2(g)  2SO3(g);ΔH<0。某溫度下,將2 mol SO2和1 mol O2置于10 L密閉容器中,反應達平衡后,SO2的平衡轉化率(α)與體系總壓強(p)的關系如圖甲所示。則下列說法正確的是
2SO3(g);ΔH<0。某溫度下,將2 mol SO2和1 mol O2置于10 L密閉容器中,反應達平衡后,SO2的平衡轉化率(α)與體系總壓強(p)的關系如圖甲所示。則下列說法正確的是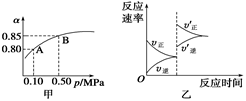
| A.由圖甲知,A點SO2的平衡濃度為0.4 mol/L |
| B.由圖甲知,B點SO2、O2、SO3的平衡濃度之比為2∶1∶2 |
| C.達平衡后,縮小容器容積,則反應速率變化圖象可以用圖乙表示 |
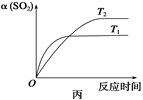
| D.壓強為0.50 MPa時不同溫度下SO2轉化率與溫度關系如丙圖,則T2>T1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com