
【題目】NaHSO3可被過量KIO3氧化,當NaHSO3完全消耗時才有I2析出。某課題組用0.02mol/LNaHSO3溶液和0.02mol/L KIO3溶液,以及淀粉作指示劑,通過測定溶液變藍所用時間來探究影響化學反應速率的因素。
(1)寫出NaHSO3溶液與過量KIO3溶液反應生成I2的離子方程式:__________________________。
(2)調節反應物濃度和溫度進行對比實驗,記錄結果如下:
編號 | NaHSO3溶液(mL) | KIO3溶液(mL) | H2O(mL) | 反應溫度(℃)/ | 變藍時間(t/s) |
① | 10 | 15 | a | 10 | t1 |
② | 10 | 40 | 0 | 10 | t2 |
③ | 10 | b | 0 | 20 | t3 |
表中a=_________,b=_________。
(3)改變反應溫度,重復實驗③,得到溫度(T)與溶液變藍所需時間(t)的關系如下圖所示(“×××”表示超過50℃后溶液不會再變藍)。

①在30℃下,若溶液變藍時,I2的物質的量為n mol,則從反應開始至溶液變藍,IO3-的平均反應速率為_______mol·L-1·s-1(寫出表達式即可,不要化簡)。
②根據圖像,請你描述低于50℃時,溶液變藍所需時間與反應溫度的關系:__________________。
(4)將NaHSO3溶液與KIO3溶液混合(預先加入可溶性淀粉為指示劑),用速率檢測儀檢測出起始階段反應速率逐漸增大,一段時間后反應速率又逐漸減小。課題組在排除濃度、溫度等影響因素后,對起始階段反應速率逐漸增大的原因提出如下假設,請你完成假設二:
假設一:反應生成的I2對反應起催化作用;I2濃度越大反應速率越快;
假設二:________________________________________________________;
假設三:________________________________________________________;
(5)請你設計實驗驗證上述假設一,完成下表中內容(反應速率可用測速儀測定)。
實驗方案 | 預期實驗現象和結論 |
第一步:在燒杯甲中將NaHSO3溶液與過量KIO3 溶液混合, 用測速儀測定起始時的反應速率V(甲) 第二步:在燒杯乙中________________________,測定其起始階段的相同時間內的反應速率V(乙) | 若__________,則假 設一成立 |
【答案】 2IO3-+5HSO3-=5 SO42- +I2+3H++H2O 25 40 ![]() 溫度低于30℃時,溫度越高,溶液變藍所需時間越短 溫度高于30℃時,溫度越高,溶液變藍所需時間越長 反應生成的H+對反應起催化作用,H+濃度越大反應速率越快反應生成的SO42-對反應起催化作用,SO42- 濃度越大反應速率越快 在燒杯乙中進行同一反應(不同的是乙燒杯中預先加入少量I2,其他反應條件均完全相同) 若V(甲)< V(乙)則假設一成立
溫度低于30℃時,溫度越高,溶液變藍所需時間越短 溫度高于30℃時,溫度越高,溶液變藍所需時間越長 反應生成的H+對反應起催化作用,H+濃度越大反應速率越快反應生成的SO42-對反應起催化作用,SO42- 濃度越大反應速率越快 在燒杯乙中進行同一反應(不同的是乙燒杯中預先加入少量I2,其他反應條件均完全相同) 若V(甲)< V(乙)則假設一成立
【解析】試題分析:本題考查設計實驗方案探究外界條件對化學反應速率的影響。
(1)NaHSO3溶液與過量KIO3溶液反應生成I2,KIO3被還原為I2,NaHSO3被氧化,可寫出HSO3-+IO3-→SO42-+I2,根據得失電子守恒可配平5HSO3-+2IO3-→5SO42-+I2,結合原子守恒和電荷守恒得離子方程式為2IO3-+5HSO3-=5SO42- +I2+3H++H2O。
(2)通過比較分析,實驗①和實驗②反應溫度相同,實驗①和實驗②是探究反應物KIO3濃度對化學反應速率的影響,10+15+a=10+40,a=25。實驗②和實驗③是探究溫度對化學反應速率的影響,濃度必須相同,b=40。
(3)①根據圖像在30℃下,從反應開始到溶液變藍需要65s;若溶液變藍時,I2的物質的量為n mol,根據I守恒,消耗的IO3-物質的量為2nmol,υ(IO3-)=2nmol![]() [(10+40)
[(10+40)![]() 10-3L]
10-3L] ![]() 65s=
65s=![]() mol·L-1·s-1。
mol·L-1·s-1。
②根據圖像,低于50℃時,溶液變藍所需時間與反應溫度的關系:溫度低于30℃時,溫度越高,溶液變藍所需時間越短;溫度高于30℃時,溫度越高,溶液變藍所需時間越長。
(4)課題組排除了濃度、溫度等影響因素,由于該反應中沒有氣體參與,所以對起始階段反應速率逐漸增大的影響因素為催化劑,沒有添加催化劑,所以起催化作用的應猜想為反應的生成物。假設一:反應生成的I2對反應起催化作用,I2濃度越大反應速率越快;假設二:反應生成的H+對反應起催化作用,H+濃度越大反應速率越快;假設三:反應生成的SO42-對反應起催化作用,SO42- 濃度越大反應速率越快。
(5)設計實驗驗證假設一,即設計實驗方案驗證I2的濃度對化學反應速率的影響。用控制變量法,乙中盛放與甲中相同的NaHSO3溶液與過量KIO3 溶液,只不過在乙中燒杯中預先加入少量I2,測定其起始階段的相同時間內的反應速率V(乙)。若V(甲)![]() V(乙),則假設一成立。
V(乙),則假設一成立。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案 目標測試系列答案
目標測試系列答案科目:高中化學 來源: 題型:
【題目】實驗室制氧氣時,若取24.5g氯酸鉀,與一定量二氧化錳共熱,完全反應可生成氯化鉀物質的量是多少?生成的氧氣在標準狀況下體積是多少?__________,__________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
A. Na2O2用作呼吸面具的供氧劑B. NaHCO3的熱穩定性大于Na2CO3
C. 乙醇可與金屬鈉反應放出氫氣D. 鈉久置在空氣中最終產物為Na2CO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國科學技術名詞審定委員會已確定第116號元素Lv的名稱為鉝.關于 ![]() Lv的敘述錯誤的是( )
Lv的敘述錯誤的是( )
A.原子序數116
B.中子數177
C.核外電子數116
D.相對原子質量293
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關氯元素及其化合物的表示正確的是( )
A.質子數為17、中子數為20的氯原子: ![]() Cl
Cl
B.氯離子(Cl﹣)的結構示意圖: 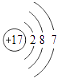
C.氯分子的電子式: ![]()
D.氯化氫的結構式:H﹣Cl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗事實所引出的相應結論正確的是
選項 | 實驗事實 | 結論 |
A | 其他條件相同,Na2S2O3溶液濃度越大,析出硫沉淀所需時間越短 | 當其他條件不變時,增大反應物濃度化學反應速率加快 |
B | 在化學反應前后,催化劑的質量和化學性質都沒有發生改變 | 催化劑一定不參加化學反應 |
C | H+濃度相同的鹽酸和醋酸分別與等質量的形狀相同的鋅粒在不同環境下反應 | 反應開始時速率相同 |
D | 在容積可變的密閉容器中發生反應H2(g)+I2(g) | 正反應速率加快,逆反應速率不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【2016樟樹市模擬】Fe2O3+3CO![]() 2Fe+3CO2 是煉鐵高爐中發生的一個可逆反應.早在19世紀的歐洲,煉鐵工程師就發現在其他條件不變時,增加高爐的高度,高爐尾氣中CO的比例竟然沒有改變.關于這一事實,下列說法不合理的是( )
2Fe+3CO2 是煉鐵高爐中發生的一個可逆反應.早在19世紀的歐洲,煉鐵工程師就發現在其他條件不變時,增加高爐的高度,高爐尾氣中CO的比例竟然沒有改變.關于這一事實,下列說法不合理的是( )
A.一定條件下,任何可逆反應的進程都有一定的限度,所以CO不可能完全轉化
B.尾氣中CO的比例不變,說明反應達到了這一條件下的化學平衡狀態
C.尾氣中CO的比例不變,是因為CO 的消耗速率與CO 生成速率相等
D.CO是氣體,鐵礦石(主要成分Fe2O3)是固體,CO 與鐵礦石接觸不充分
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com