
2.第Ⅱ象限符號為“+、-”(△S>0、△H<0)時化學反應的方向--所有溫度下反應均能自發進行
[例2]已知雙氧水、水在298K、100kPa時的標準摩爾生成焓的數據如下:
|
物 質 |
△fH /kJ·mol-1 /kJ·mol-1 |
|
H2O(l) |
-258.8 |
|
H2O2(l) |
-191.2 |
|
O2(g) |
0 |
(1)試由以上數據計算雙氧水發生分解反應的熱效應。
(2)若雙氧水發生分解反應生成液態水和氧氣時,其△S==57.16J·mol-1·K-1
試判斷該反應在常溫下能否自發進行。若溫度達到2000K時,反應能否自發進行。
[解析]
(1)根據△H ==H(產物)-H(反應物)得,△H ==2×(-258.8kJ·mol-1)+0-2×(-191.2kJ·mol-1)=== -135.2kJ·mol-1。
(2)在298K時,△H-T△S=-135.2kJ·mol-1-(298K×10-3×57.16kJ·mol-1·K-1) == -152.23 kJ·mol-1<0
∴該反應在常溫下可自發進行。
溫度達到2000K,且假定焓變和熵變不隨溫度變化而變化,△H-T△S=-135.2kJ·mol-1-(2000K×10-3×57.16kJ·mol-1·K-1)== -249.52kJ·mol-1<0
故△S>0、△H<0時,僅從符號上進行分析,無論溫度如何變化,恒有△H-T△S<0,故化學反應的方向--所有溫度下反應均能自發進行。
1.第Ⅰ象限符號為“+、+”(△S>0、△H>0)時化學反應的方向--高溫下反應自發進行
[例1]石灰石的分解反應為:CaCO3(s)==CaO(s) +CO2(g)
其△H(298K)==178.2kJ·mol-1,△S(298K)== 169.6J·mol-1·K-1
169.6J·mol-1·K-1
試根據以上數據判斷該反應在常溫下是否自發進行?其分解溫度是多少?
[解析]
∵△H-T△S=178.2kJ·mol-1-298K×10×-3×169.6kJ·mol-1·K-1
==128kJ·mol-1>0
∴298K時,反應不能自發進行。即常溫下該反應不能自發進行。
由于該反應是吸熱的熵增加反應,升高溫度可使△H-T△S<0,假設反應焓變和熵變不隨溫度變化而變化,據△H-T△S<0可知,T>△H/△S ==178.2kJ·mol-1/10×-3×169.6kJ·mol-1·K-1==1051K,即溫度高于778℃時反應可自發進行。
4.焓變和熵變對反應方向的共同影響--“四象限法”判斷化學反應的方向。
在二維平面內建立坐標系,第Ⅰ象限的符號為“+、+”,第Ⅱ象限的符號為“+、-”,第Ⅲ象限的符號為“-、-”,第Ⅳ象限的符號為“-、+”。借肋于數學坐標系四個象限的符號,聯系焓變與熵變對反應方向的共同影響,可以從熱力學的角度快速判斷化學反應的方向。
在溫度、壓強一定的條件下,化學反應的方向的判據為:
△H-T△S<0 反應能自發進行
△H-T△S==0反應達到平衡狀態
△H-T△S>0反應不能自發進行
 反應放熱和熵增加都有利于反應自發進行。該判據指出的是化學反應自發進行的趨勢。
反應放熱和熵增加都有利于反應自發進行。該判據指出的是化學反應自發進行的趨勢。
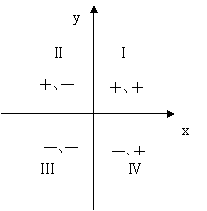
|

2.反應熵變與反應方向
(1)熵:描述大量粒子混亂度的物理量,符號為S,單位J·mol-1·K-1,熵值越大,體系的混亂度越大。
(2)化學反應的熵變(△S):反應產物的總熵與反應物總熵之差。
(3)反應熵變與反應方向的關系
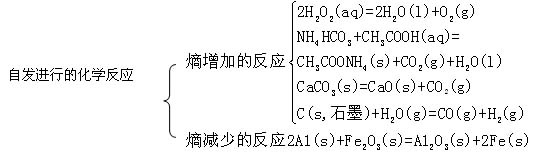
①多數熵增加的反應在常溫常壓下均可自發進行。產生氣體的反應、氣體物質的量增加的反應,熵變都是正值,為熵增加反應。
②有些熵增加的反應在常溫下不能自發進行,但在較高溫度下則可自發進行。如碳酸鈣的分解。
③個別熵減少的反應,在一定條件下也可自發進行。如鋁熱反應的△S== -133.8 J·mol-1·K-1,在點燃的條件下即可自發進行。
1.反應焓變與反應方向
(1)多數能自發進行的化學反應是放熱反應。如氫氧化亞鐵的水溶液在空氣中被氧化為氫氧化鐵的反應是自發的,其△H(298K)==-444.3kJ·mol-1
(2)部分吸熱反應也能自發進行。
如NH4HCO3(s)+CH3COOH(aq)==CH3COONH4(aq)+CO2(g)+H2O(l),其△H(298K)== +37.30kJ·mol-1。
(3)有一些吸熱反應在常溫下不能自發進行,在較高溫度下則能自發進行。如碳酸鈣的分解。
因此,反應焓變不是決定反應能否自發進行的唯一依據。
4.活化能:對基元反應而言,活化分子的平均能量與普通反應物分子的平均能量之差叫該反應的活化能(用Ea表示,其單位為kJ/mol)。活化能越大,反應越難進行。
催化劑能降低化學反應的活化能,增大活化分子的百分數,進而增大化學反應速率。催化劑具有選擇性。
解釋化學反應速率快慢的鏈條思維:活化能→活化分子→有效碰撞→化學反應速率。
 影響 影響外因 |
單位體積內 |
有效碰撞次數 |
化學反應速率 |
||
|
分子總數 |
活化分子數 |
活化分子百分數 |
|||
|
增大反應物濃度 |
增加 |
增加 |
不變 |
增加 |
加快 |
|
增大壓強 |
增加 |
增加 |
不變 |
增加 |
加快 |
|
升高溫度 |
不變 |
增加 |
增大 |
增加 |
加快 |
|
使用催化劑 |
不變 |
增加 |
增大 |
增加 |
加快 |
|

[例1](2010福建卷,12) 化合物Bilirubin在一定波長的光照射下發生分解反應,反應物嘗試隨反應時間變化如右圖所示,計算反應4~8 min間的平均反應速率和推測反應16 min 反應物的濃度,結果應是
化合物Bilirubin在一定波長的光照射下發生分解反應,反應物嘗試隨反應時間變化如右圖所示,計算反應4~8 min間的平均反應速率和推測反應16 min 反應物的濃度,結果應是

A 2.5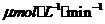 和2.0
和2.0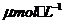
B 2.5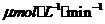 和2.5
和2.5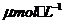
C 3.0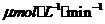 和3.0
和3.0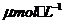
D 3.0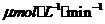 和3.0
和3.0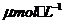
解析:本題考察化學反應速率的計算
第8秒與第4秒時反應物濃度差△C為10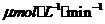 ,
,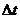 為4秒,所以在4~8
為4秒,所以在4~8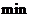 間的平均反應速率為2.5
間的平均反應速率為2.5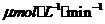 ,可以排除CD兩個答案;圖中從0
,可以排除CD兩個答案;圖中從0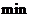 開始到8
開始到8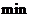 反應物濃度減低了4倍,根據這一幅度,可以推測從第8
反應物濃度減低了4倍,根據這一幅度,可以推測從第8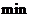 到第16分也降低4倍,即由10
到第16分也降低4倍,即由10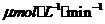 降低到2.5
降低到2.5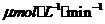 ,因此推測第16
,因此推測第16 反應物的濃度為2.5
反應物的濃度為2.5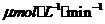 ,所以可以排除A而選B
,所以可以排除A而選B
答案:B
[例2](2010全國卷1,27)
(15分)在溶液中,反應A+2B C分別在三種不同實驗條件下進行,它們的起始濃度均為
C分別在三種不同實驗條件下進行,它們的起始濃度均為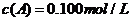 、
、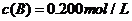 及
及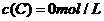 。反應物A的濃度隨時間的變化如下圖所示。
。反應物A的濃度隨時間的變化如下圖所示。
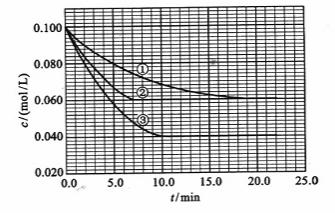
請回答下列問題:
(1)與①比較,②和③分別僅改變一種反應條件。所改變的條件和判斷的理由是:
②_______________;
③_______________;
(2)實驗②平衡時B的轉化率為_________;實驗③平衡時C的濃度為____________;
(3)該反應的 __
__ _______0,判斷其理由是__________________________________;
_______0,判斷其理由是__________________________________;
(4)該反應進行到4.0min時的平均反應速度率:
實驗②: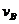 =__________________________________;
=__________________________________;
實驗③: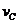 =__________________________________。
=__________________________________。
[解析](1)②使用了(正)催化劑;理由:因為從圖像可看出,兩者最終的平衡濃度相同,即最終的平衡狀態相同,而②比①所需要的時間短,顯然反應速率加快了,故由影響反應速率和影響平衡的因素可知是加入(正)催化劑;③升高溫度;理由:因為該反應是在溶液中進行的反應,所以不可能是改變壓強引起速率的改變,又由于各物質起始濃度相同,故不可能是改變濃度影響反應速率,再由于③和①相比達平衡所需時間短,平衡時濃度更小,故不可能是改用催化劑,而只能是升高溫度來影響反應速率的
(2)不妨令溶液為1L,則②中達平衡時A轉化了0.04mol,由反應計量數可知B轉化了0.08mol,所以B轉化率為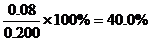 ;同樣在③中A轉化了0.06mol,則生成C為0.06mol,體積不變,即平衡時C(c)=0.06mol/L
;同樣在③中A轉化了0.06mol,則生成C為0.06mol,體積不變,即平衡時C(c)=0.06mol/L
(3)  ﹥0;理由:由③和①進行對比可知升高溫度后A的平衡濃度減小,即A的轉化率升高,平衡向正方向移動,而升溫是向吸熱的方向移動,所以正反應是吸熱反應,
﹥0;理由:由③和①進行對比可知升高溫度后A的平衡濃度減小,即A的轉化率升高,平衡向正方向移動,而升溫是向吸熱的方向移動,所以正反應是吸熱反應, ﹥0
﹥0
(4)從圖上讀數,進行到4.0min時,實驗②的A的濃度為:0.072mol/L,則△C(A)=0.10-0.072=0.028mol/L,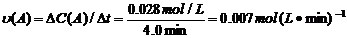 ,∴
,∴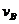 =2
=2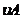 =0.014mol(L·min)-1;進行到4.0mi實驗③的A的濃度為:0.064mol/L:△C(A,)
=0.10-0.064=0.036mol/L,
=0.014mol(L·min)-1;進行到4.0mi實驗③的A的濃度為:0.064mol/L:△C(A,)
=0.10-0.064=0.036mol/L,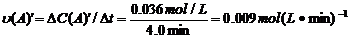 ,∴
,∴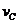 =
=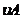 =0.0089mol(L·min)-1
=0.0089mol(L·min)-1
[答案](1)②加催化劑;達到平衡的時間縮短,平衡時A的濃度未變
③溫度升高;達到平衡的時間縮短,平衡時A的濃度減小
(2)40%(或0.4);0.06mol/L;(3)﹥;升高溫度向正方向移動,故該反應是吸熱反應
(4)0.014mol(L·min)-1;0.008mol(L·min)-1
[命題意圖]考查基本理論中的化學反應速率化學平衡部分,一些具體考點是:易通過圖像分析比較得出影響化學反應速率和化學平衡的具體因素(如:濃度,壓強,溫度,催化劑等)、反應速率的計算、平衡轉化率的計算,平衡濃度的計算, 的判斷;以及計算能力,分析能力,觀察能力和文字表述能力等的全方位考查。
的判斷;以及計算能力,分析能力,觀察能力和文字表述能力等的全方位考查。
[點評]本題所涉及的化學知識非常基礎,但是能力要求非常高,觀察和分析不到位,就不能準確的表述和計算,要想此題得滿分必須非常優秀才行!此題與2009年全國卷II理綜第27題,及安微卷理 綜第28題都極為相似,有異曲同工之妙,所以對考生不陌生!
綜第28題都極為相似,有異曲同工之妙,所以對考生不陌生!
|

第2課時 化學反應的方向及判據
2.影響反應速率的因素
內因:反應物的性質是反應速率大小的決定因素。
外因:主要因素有濃度、溫度、壓強、催化劑等。
(1)濃度:其它條件不變時,增大反應物濃度,化學反應速率加快。
(2)溫度:其它條件不變時,升高溫度,化學反應速率加快。一般來說,溫度每升高10℃,反應速率增大為原來的2-4倍。
(3)壓強:其它條件不變時,增大壓強,對于有氣體物質參加的化學反應,反應速率加快。
(4)催化劑:使用正催化劑,能加快反應速率。未特別指明時,均指正催化劑。
1.化學反應速率的表示方法:通常用單位時間內反應物濃度的減少或者生成物濃度的增加來表示化學反應速率。單位:mol/L·s ;mol/L·min ;mol/L·h等。
對于任一化學反應:aA +bB==cC +dD可用υ(A)、υ(B)、υ(C)、υ(D)表示其速率,則有υ(A):υ(B):υ(C):υ(D)== a:b:c:d,即化學反應速率之比等于化學方程式中各物質的系數之比(還可等于其學其濃度變化之比或物質的量變化之比)。
2、熵:描述體系滋亂度的物理理 單位:J.mol-1 .k-1 符號S
影響熵的因素:①同一條件下,不同物質熵不同②同一物質,聚集狀態不同熵不同S(g)>S(l)>S(s)
反應的熵變(△S):△S=S反應產物-S反應物
T、P一定,反應焓變和熵變共同影響反應方向,反應方向判據:△H-T△S<0 反應能自發進行;△H-T△S=0 反應達到平衡狀態;△H-T△S>0 反應不能自發進行

第1課時 化學反應速率
1、反應焓變是與反應能否自發進行有關的一個因素,但不是惟一因素

湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com